题目内容
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是 ;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C+ N2  AlN+ CO(配平)
AlN+ CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
Ⅰ、(1)盐酸(硫酸或硝酸);(2分) (2)Al2O3中含有SiO2杂质;(2分)
Ⅱ、(3)2Al2O3(熔融)  4Al + 3O2↑(3分)
4Al + 3O2↑(3分)
Ⅲ、(4) 1 Al2O3 + 3 C + 1 N2 === 2 AlN + 3 CO (2分) (5) AB(2分)
【解析】
试题分析:氧化铝、二氧化硅均能与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,氧化铁不反应,则滤渣a是氧化铁。要从偏铝酸钠和硅酸钠的混合溶液中得到氢氧化铝,则需要加入过量的盐酸生成氯化铝和硅酸沉淀,即滤渣b是硅酸,溶液b中含有氯化铝,通入足量的氨气即生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,则
(1)由以上分析可知试剂A是盐酸;
(2)若向溶液a中通入过量的CO2,则生成氢氧化铝和硅酸沉淀,不溶物煅烧后得到的氧化铝中将含有二氧化硅杂质。
(3)电解熔融的氧化铝生成铝和氧气,反应的化学方程式为2Al2O3(熔融)  4Al + 3O2↑。
4Al + 3O2↑。
(4)根据方程式可知,在反应中碳元素的化合价从0价升高到+2价,失去2个电子。氮元素的化合价从0价降低到-3价,得到3个电子,则根据电子得失守恒和原子守恒可知配平后的化学方程式为Al2O3 +3C + N2 =2AlN +3CO。
(5)方法①和方法②相比较,需要较多能量,且生成的固体易残留在AlN中,反应①AlN是还原产物,反应②没有发生氧化还原反应,故答案为:AB。
考点:考查从铝土矿中制备氧化铝的流程图分析、铝的冶炼、氧化还原反应应用等

已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
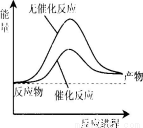
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量