题目内容
17.在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是( )| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
分析 根据n=$\frac{V}{{V}_{m}}$、m=nM计算出氨气的物质的量、质量,再根据氨气的质量、水的质量计算出溶液质量,然后根据溶液质量、溶液密度及表达式V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$计算出此氨水的物质的量浓度.
解答 解:A L氨气的物质的量为:n(NH3)=$\frac{AL}{22.4L/mol}$=$\frac{A}{22.4}$mol,
氨气的质量为:m(NH3)=17g/mol×$\frac{A}{22.4}$mol=$\frac{17A}{22.4}$g,
BmL水的质量约为Bg,则所得氨水溶液的质量为:$\frac{17A}{22.4}$g+B g,
所得溶液的体积为:V=$\frac{\frac{17A}{22.4}+B}{1000ρ}$=$\frac{17A+22.4B}{22400ρ}$L,
则此氨水的物质的量浓度为:c(NH3)=$\frac{1000Aρ}{17A+22.4B}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,特别需要明确:计算溶液体积时,需要根据溶液的质量、溶液的密度进行计算,不能直接利用气体的体积计算.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
7.下列说法不正确的是( )
| A. | 乙烷与氯气在光照条件下发生加成反应 | |
| B. | 甲烷和乙烯都可以与氯气反应,反应类型不同 | |
| C. | 蔗糖、油脂、蛋白质都可以水解 | |
| D. | 乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下2.24L己烷分子中含1.9NA对共用电子 | |
| B. | 常温下4.4g的CO2和N2O混合物中,所含有的原子数为0.3 NA | |
| C. | 0.1mol Fe与0.1 mol Cl2反应时失电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g 电路中就转移NA个电子 |
9.下列有关说法正确的是( )
| A. | 化学实验室中的蔗糖纯度很高,可用来食用 | |
| B. | 实验室中制取完有毒气体,开窗通风即可 | |
| C. | 为了节约用水,实验室中用过的废洗液,可以用来冲洗厕所 | |
| D. | 不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道 |
6.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
| A. | Cu能与浓硝酸反应,但不能与浓盐酸反应 | |
| B. | Cu与浓硝酸反应比与稀硝酸反应快 | |
| C. | N2与O2在常温、常压下不反应,放电时可反应 | |
| D. | Fe与浓盐酸反应比与稀盐酸反应快 |
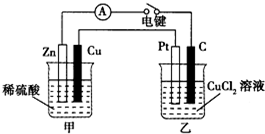 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题: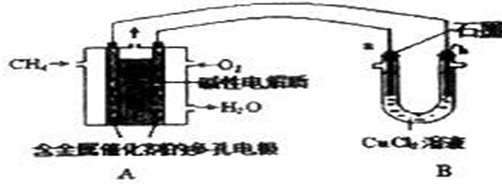
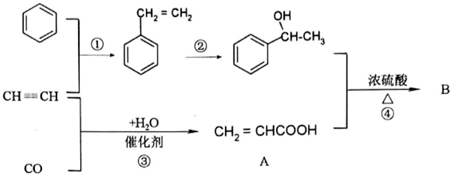
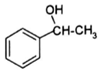 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$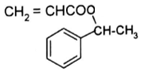 +H2O.
+H2O. 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: