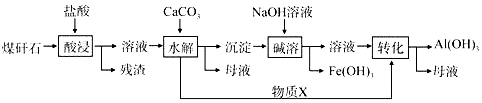
题目内容
10. A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知:①F的原子序数为25,其余均为短周期元素;
②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三原子p轨道上均有2个未成对电子;
③元素C、D、E在同一周期,且C原子中没有未成对电子.
请回答下列问题:
(1)元素A与元素B的电负性较大的为O,元素C与元素D的第一电离能的较小的为Al(填入相应的元素符号).
(2)F的价电子排布式为3d54s2.
(3)元素B与元素E形成的晶体中原子间形成的化学键属于AC
A.σ键 B.π键 C.极性键 D非极性键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里中心原子的杂化轨道类型为sp2,分子的空间构型为平面三角形
(5)根据等电子原理,写出由元素原子A与元素B构成的一种双原子极性分子的结构式C≡O.
(6)已知金刚石的晶胞如图所示,阿伏伽德罗常数的值为NA,该晶体中最近的两个C原子之间的距离为
 cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.
cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.
分析 A、B、C、D、E、F六种元素的原子序数依次递增,
①F的原子序数为25,其余均为短周期元素,F为Mn元素;
②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三原子p轨道上均有2个未成对电子,这几种原子序数都小于F,所以AB位于第二周期、E位于第三周期,A为C、B为O、E为Si元素;
③元素C、D、E在同一周期,且C原子中没有未成对电子,为第三周期,原子序数小于Si,则C是Mg、D为Al元素;
(1)同一周期元素,元素电负性随着原子序数增大而增大;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)F是Mn元素,根据构造原理书写该原子核外电子排布式;
(3)B是O元素,E是Si元素,元素B与元素E形成的晶体是二氧化硅晶体,二氧化硅晶体是原子晶体;二氧化硅晶体中Si-O原子之间形成共价单键;
(4)A是C元素,B是O元素,由氢元素与A、B两元素共同构成的相对分子质量为30的分子是HCHO,甲醛分子中中心原子是碳原子,碳原子含有3个σ键且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式及空间构型;
(5)价电子数相同原子个数相同的微粒互为等电子体,等电子体结构相似;
(6)根据晶体中最近的两个C原子之间的距离的4倍为晶体的体长,再求晶体边长,从而求出晶体密度.
解答 解:A、B、C、D、E、F六种元素的原子序数依次递增.
①F的原子序数为25,其余均为短周期元素,则F是Mn元素.
②元素A与元素B同周期,元素A与元素E同主族,A、B、E三原子p轨道上均有2个未成对电子,A的原子序数最小,则A是C元素,A和B同周期,则B是O元素,E原子序数大于B,所以E位于第三周期,则E是Si元素.
③元素C、D、E在同一周期,且C原子中没有未成对电子,C的原子序数小于E,则C是Mg,D的原子序数大于C小于E,则D是Al元素.
(1)A是C元素,B是O元素,同一周期元素中,元素的电负性随着原子序数的增大而增大,所以元素A与元素B的电负性大小比较为O>C;
C是Mg元素,D是Al元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于相邻主族元素的第一电离能,所以元素C与元素D的第一电离能的大小比较为:Mg>Al,故答案为:O,Mg
(2)F是Mn元素,其原子核外有25个电子,根据构造原理知,F的价电子排布式为3d54s1 3d54s1,故答案为:3d54s1;
(3)B是O元素,E是Si元素,元素B与元素E形成的晶体是二氧化硅晶体,二氧化硅晶体的构成微粒是原子,所属的晶体类型为原子晶体,在该晶体中每个硅原子和4个氧原子形成4个硅氧极性键,每个氧原子和2个硅原子形成2个硅氧键,原子间以共价单键相结合,所以原子间形成的共价键属于σ键,故选A、C,故答案为:原子;A、C;
(4)A是C元素,B是O元素,由氢元素与A、B两元素共同构成的相对分子质量为30的分子是HCHO,甲醛分子中中心原子是碳原子,碳原子含有3个σ键且不含孤电子对,所以甲醛里中心原子的杂化轨道类型为sp2,分子的空间构型为平面三角形,故答案为:sp2;平面三角形;
(5)根据等电子原理,A是C元素,B是O元素,由元素A与元素B构成的一种双原子极性分子是CO,CO和氮气分子实验等电子体,等电子体的结构相似,所以一氧化氮的结构式为:C≡O,故答案为:C≡O;
(6)晶体中最近的两个原子之间的距离为该晶体晶胞体长的1/4,该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,晶胞的质量为$\frac{8×12g/mol}{NA/mol}$=$\frac{96}{{N}_{A}}$g,
晶胞的体积为($\frac{4×\sqrt{3\root{3}{\frac{96}{ρNA}}}}{\sqrt{3}}$)3=$64×\frac{96}{ρNA}$,晶胞的密度为$\frac{\frac{96}{NA}}{64×\frac{96}{ρNA}}$=$\frac{ρ}{64}$g/cm3,故答案为:$\frac{ρ}{64}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布、元素周期律等知识点,侧重考查学生分析判断及空间想象能力、计算能力等,明确基本理论及物质结构是解本题关键,要知道该晶胞中哪两个原子距离最近是解答本题难点,题目难度较大.

| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |
| A. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 | B. |  | ||
| C. |  | D. |  |
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶
液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如下表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 如图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,
则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题: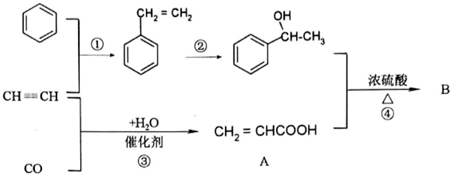
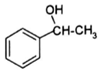 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$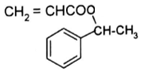 +H2O.
+H2O.