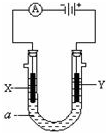
题目内容
已知X、Y、Z、W四种短周期主族元素在周期表中相对位置如图所示,下列说法不正确的是( )
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种短周期元素,由在周期表中的相对位置可知,X、Y为第二周期元素,Z、W为第三周期元素,
A、当X、Y形成的离子电子层数相同时,X的离子半径大于Y离子;
B、若Y为Be,W为Mg,则W的原子序数是Y的原子序数的3倍;
C、非金属性越强,氢化物越稳定,根据非金属性的递变规律分析;
D、若Z元素最高价氧化物的水化物是强酸,则Z为S元素,则W为Cl元素.
A、当X、Y形成的离子电子层数相同时,X的离子半径大于Y离子;
B、若Y为Be,W为Mg,则W的原子序数是Y的原子序数的3倍;
C、非金属性越强,氢化物越稳定,根据非金属性的递变规律分析;
D、若Z元素最高价氧化物的水化物是强酸,则Z为S元素,则W为Cl元素.
解答:
解:A、如果X、Y形成的离子电子层数相同时,核电荷数越大,离子半径越小,X的离子半径大于Y离子,故A正确;
B、若Y为Be元素,其原子序数为4,W为Mg,原子序数为12,则W的原子序数可能是Y的原子序数的3倍,故B正确;
C、同主族元素,从上到下元素的非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则W的气态氢化物的稳定性一定比Y的弱,故C错误;
D、Z、W都是第三周期元素,如果Z元素最高价氧化物的水化物是强酸,则Z为S元素、W为Cl元素,W元素的单质氯气具有强氧化性,故D正确;
故选C.
B、若Y为Be元素,其原子序数为4,W为Mg,原子序数为12,则W的原子序数可能是Y的原子序数的3倍,故B正确;
C、同主族元素,从上到下元素的非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则W的气态氢化物的稳定性一定比Y的弱,故C错误;
D、Z、W都是第三周期元素,如果Z元素最高价氧化物的水化物是强酸,则Z为S元素、W为Cl元素,W元素的单质氯气具有强氧化性,故D正确;
故选C.
点评:本题考查位置结构性质关系应用,题目难度中等,注意元素的不确定性,注意掌握同主族、同周期元素性质的递变规律,试题侧重基础知识的考查,有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列有关物质的表达式正确的是( )
| A、乙酸乙酯的结构简式:CH3CH2COOCH3 |
B、2-甲基-2-戊烯的键线式: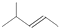 |
| C、乙醇的结构简式:CH3CH2OH |
| D、1,3-丁二烯的分子式:C4H8 |
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ?mol-1 | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ?mol-1 | ||
| D、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol-1 |
将11.2g的MgCu混合物完全溶解于足量的硝酸中,收集反应产生的X气体.再向所得溶液中加入适量的氢氧化钠溶液,产生21.4g沉淀.根据题意推断气体X的成分可能是( )
| A、0.3 mol NO2和0.3 mol NO |
| B、0.1 mol NO、0.2 mol NO2和0.05 mol N2O4 |
| C、0.2 mol NO2和0.1 mol N2O4 |
| D、0.6 mol NO |
下列有关有机物的叙述正确的是( )
A、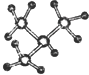 和 和 互为同系物 互为同系物 |
| B、用系统命名法命名新戊烷为2,2-二甲基丙烷 |
| C、相对分子质量相近的醇和烷烃相比,醇的沸点远远低于烷烃 |
| D、石油化工中的分馏、裂化、裂解都是通过化学变化得到轻质油 |
碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃(不考虑反异构和立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列叙述正确的是( )
| A、合金材料中不可能含有非金属元素 |
| B、SiO2为酸性氧化物,故不能与任何酸发生化学反应 |
| C、用砂纸打磨过的铝箔放在洒精灯焰上不燃烧,说明铝不易与O2反应 |
| D、FeCl2、FeCl3、Fe(OH)3三种物质都可以直接通过化合反应制取 |
下列变化中,属于放热反应的是( )
| A、H2O(g)═H2O(l)△H=-44kJ/mol |
| B、2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
C、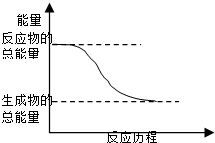 能量变化如图所示的化学反应 |
| D、形成化学键时放出能量的化学反应 |