题目内容
8.反应:X(g)+3Y(g)?2Z(g)△H<0,在不同温度、不同压强(P2>P1)下,达平衡时,混合气体中Z的百分含量随温度变化的曲线应为( )| A. | 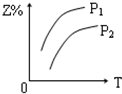 | B. | 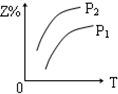 | C. | 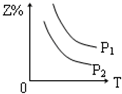 | D. | 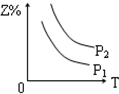 |
分析 由方程式X(气)+3Y(气)?2Z(气)+热量,可知:反应放热,升高温度平衡向逆反应方向移动,反应前气体的化学计量数之和大于生成物气体的化学计量数之和,则增大压强平衡向正反应方向移动,以此判断生成物Z的百分含量的变化.
解答 解:由方程式X(气)+3Y(气)?2Z(气)+热量,可知:反应放热,升高温度平衡向逆反应方向移动,则生成物Z的百分含量减小,可排除A、B选项;
反应前气体的化学计量数之和大于生成物气体的化学计量数之和,则增大压强平衡向正反应方向移动,则生成物Z的百分含量增大,又P1>P2,则C正确,D错误.
故选C.
点评 本题考查化学平衡移动图象问题,题目难度不大,注意从化学方程式的反应热以及化学计量数关系判断外界条件对平衡移动的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列物质的名称和化学式不相符的是( )
| A. | 铝土矿(Al2O3) | B. | 磁性氧化铁(FeO) | ||
| C. | 铁红(Fe2O3) | D. | 明矾[KAl(SO4)2•12H2O] |
19.33.5g Na2O2吸收CO2后,其质量增加到36.3g,则被吸收的CO2的质量是( )
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
3.下列物质:①盐酸 ②氨水 ③CO2气体 ④SO3气体 ⑤纯碱粉末 ⑥酒精 ⑦铜 ⑧熔融的NaCl ⑨水玻璃,以下叙述不正确的是( )
| A. | 属于电解质的有3种 | B. | 属于纯净物的有6种 | ||
| C. | 属于非电解质的有3种 | D. | 上述状态下能导电的有5种 |
13.下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是( )
| A. | 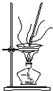 可用于除去碳酸钠固体中含有的少量碳酸氢钠 | |
| B. | 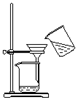 可用于碳酸钙固体和氯化钠溶液的分离 | |
| C. | 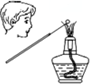 可正确观察钾元素焰色反应 | |
| D. | 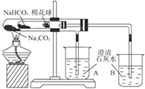 小试管中NaHCO3分解,(B)中澄清石灰水变浑浊,(A)中澄清石灰水没浑浊,说明稳定性Na2CO3>NaHCO3 |
20.飞船以铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化产生高温引发高氯酸铵反应,其方程式为2NH4ClO4═N2↑+Cl2↑+2O2↑+4H2O.下列有关叙述不正确的是( )
| A. | 上述反应属于分解反应、氧化还原反应 | |
| B. | 高氯酸铵属于盐,该反应属于离子反应 | |
| C. | 上述反应瞬间产生的高温气体是推动飞船飞行的主要因素 | |
| D. | 在反应中NH4ClO4既是氧化剂又是还原剂 |
17.(1)工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1.
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
16.向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是( )
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |