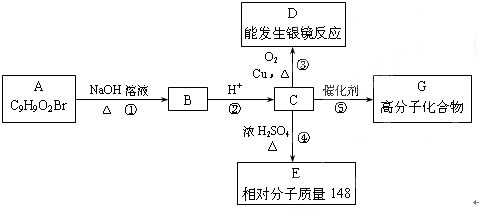
题目内容
下表中对实验操作、现象的描述及对应的解释、结论正确的是( )
| 选项 | 实验操作、现象 | 解释、结论 |
| A. | 铜片放入浓硫酸中,无明显变化 | 铜在冷的浓硫酸中会发生钝化 |
| B. | 往某氯化物溶液中滴加氨水,产生白色沉淀 | 该氯化物是AlCl3 |
| C. | 将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 | HA是弱酸 |
| D. | 往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] | 原溶液中 c(Mg2+)=5.6×10-2mol?L-1 |
| A、A | B、B | C、C | D、D |
考点:铜金属及其重要化合物的主要性质,pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质,氨的化学性质
专题:
分析:A、铜和浓硫酸需要加热发生反应常温下不易发生反应,不是钝化;
B、氯化物中加入氨水生成白色沉淀不一定是氢氧化铝;
C、将10ml某pH=3的HA溶液加水稀释到100ml,若是强酸所得溶液pH=4;
D、依据溶度积常数计算沉淀后的溶液中镁离子浓度分析;
B、氯化物中加入氨水生成白色沉淀不一定是氢氧化铝;
C、将10ml某pH=3的HA溶液加水稀释到100ml,若是强酸所得溶液pH=4;
D、依据溶度积常数计算沉淀后的溶液中镁离子浓度分析;
解答:
解:A、铜和浓硫酸需要加热发生反应,常温下不易发生反应,不是钝化,故A错误;
B、氯化物中加入氨水生成白色沉淀不一定是氢氧化铝,可以生成氢氧化镁白色沉淀等,故B错误;
C、将10ml某pH=3的HA溶液加水稀释到100ml,若是强酸所得溶液pH=4,所得溶液pH=3.8说明HA为弱酸,故C正确;
D、依据溶度积常数计算沉淀后的溶液中镁离子浓度分析,pH=9时,开始出现沉淀,Mg(OH)2的Ksp=c(Mg2+)c2(OH-)=c(Mg2+)×(
)2=5.6×10-12,c(Mg2+)=5.6×10-2mol?L-1,所以原溶液中镁离子浓度大于5.6×10-2mol?L-1,故D错误;
故选C.
B、氯化物中加入氨水生成白色沉淀不一定是氢氧化铝,可以生成氢氧化镁白色沉淀等,故B错误;
C、将10ml某pH=3的HA溶液加水稀释到100ml,若是强酸所得溶液pH=4,所得溶液pH=3.8说明HA为弱酸,故C正确;
D、依据溶度积常数计算沉淀后的溶液中镁离子浓度分析,pH=9时,开始出现沉淀,Mg(OH)2的Ksp=c(Mg2+)c2(OH-)=c(Mg2+)×(
| 10-14 |
| 10-9 |
故选C.
点评:本题考查了物质性质的分析判断,弱电解质溶液稀释后溶液PH的计算,溶度积常数的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化合物A、B、C、D各由两种元素组成,甲、乙、丙是短周期元素的三种单质.这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
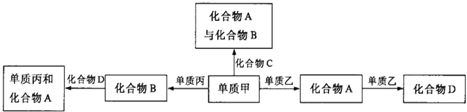

| A、上述转化关系所涉及的化合物中有一种是酸性氧化物 |
| B、甲、乙、丙三种单质的晶体一定是分子晶体 |
| C、上图所示的五个转化关系中,有三个是化合反应 |
| D、上图所示的五个转化关系中,均为氧化还原反应 |
25℃时,1mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH3?H2O四种溶液中,测得c(NH4+)分别为a、b、c、d(单位为mol/L),下列判断正确的是( )
| A、a=b=c=d |
| B、a>b>d>c |
| C、d>a>c>b |
| D、c>a>b>d |
以惰性电极电解500mL0.4mol/L的CuCl2溶液.若阳极上所产生气体的物质的量为0.25mol,则阴极上析出Cu的质量为( )
| A、16g | B、32g |
| C、19.2g | D、12.8g |
已知H2B在溶液中的电离方程式:H2B=H++HB-,HB-?H++B2-.下列叙述一定正确的是( )
| A、Na2B溶液存在:c (Na+)=2c (HB-)+2c(B2-)+2c(H2B) |
| B、NaHB溶液一定显酸性 |
| C、HB-的水解方程式:HB-+H2O?H2B+OH- |
| D、NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+=H2B |
下列关于铵盐的叙述中正确的是( )
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐中都有铵离子
⑤铵盐都能与碱反应,不能与酸反应.
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐中都有铵离子
⑤铵盐都能与碱反应,不能与酸反应.
| A、①③④ | B、②③④ |
| C、①②③④ | D、①②③④⑤ |
2012年4月22日是第43个“世界地球日”,宣传主题是“善待地球--珍惜资源、持续发展”.下列活动或行为不符合这一主题的是( )
| A、发展循环经济,构建资源节约型社会及清洁生产技术 |
| B、采用绿色化学生产工艺,提高原子利用率,建立环境友好型化工体系 |
| C、大量砍伐森林,以满足人们对木材的需求 |
| D、大力开发可再生资源,推广用乙醇汽油代替传统的燃油 |