题目内容
15. 英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.
英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.
分析 根据元素周期律可知,同周期元素从左向右第一电离能逐渐增大,电负性也逐渐增大,据此答题.
解答 解:B、C、N三种元素在同一周期,原子序数依次增大,根据元素周期律可知,它们随着元素原子序数的增大,第一电离能逐渐增大,电负性也逐渐增大,所以C、N、B的第一电离能由大到小的顺序为 N>C>B,电负性由小到大的顺序为B<C<N,
故答案为:N>C>B;B<C<N.
点评 本题考查了电负性、电离能的大小判断,难度不大,注意元素周期律的灵活运用.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
3.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
20.一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
| A. | 流出溶液的体积为(m-n) mL | B. | 流出溶液的体积为(n-m) mL | ||
| C. | 管内溶液体积等于(a-n) mL | D. | 管内溶液体积多于n mL |
5.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c(C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c(C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
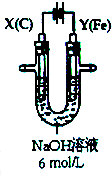 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.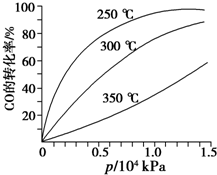 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.