题目内容
14.将1mol CH4和适量的O2在密闭容器中点燃,充分反应后CH4和O2均无剩余,产物的总质量为72g,且均为气体(101kPa,120℃),下列有关叙述不正确的是( )| A. | 反应中消耗O2 56 g | |
| B. | 所得产物中各物质的物质的量相等 | |
| C. | 若将产物通过碱石灰,不能被完全吸收 | |
| D. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重36g |
分析 由质量守恒可知氧气的质量为72g-1mol×16g/mol=56g,则氧气的物质的量为$\frac{56g}{32g/mol}$=1.75mol,1mol甲烷完全燃烧生成二氧化碳与水消耗氧气的物质的量为(1+$\frac{4}{4}$)mol=2mol>1.75mol,若生成CO与水,根据原子守恒可知消耗氧气的物质的量为$\frac{1mol+2mol}{2}$=1.5mol<1.75mol,故甲烷燃烧生成二氧化碳、一氧化碳与水,根据H原子守恒可知生成水为2mol,二氧化碳、一氧化碳总物质的量为1mol,以此来解答.
解答 解:A.由质量守恒可知氧气的质量为72g-1mol×16g/mol=56g,故A正确;
B.由原子守恒可知,生成水为2mol,二氧化碳、一氧化碳总物质的量为1mol,故B错误;
C.CO与碱石灰不反应,则产物通过碱石灰,不能被完全吸收,故C正确;
D.生成水为2mol×18g/mol=36g,则产物通过浓硫酸,充分吸收后,浓硫酸增重36g,故D正确;
故选B.
点评 本题考查化学反应的计算,为高频考点,把握完全燃烧消耗的氧气及产物的判断为解答的关键,侧重分析与计算能力的考查,注意质量守恒及原子守恒的应用,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
4.可用如图所示装置制取(必要时可加热)、净化、收集的气体是( )


| A. | 亚硫酸钠固体与硫酸反应制二氧化硫 | |
| B. | 铜与稀硝酸反应制一氧化氮 | |
| C. | 氯化铵与氢氧化钙固体反应制氨气 | |
| D. | 锌和稀硫酸反应制氢气 |
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
2.根据如图中的实验装置,回答问题:
(1)写出图中仪器a的名称:长颈漏斗.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3 $\frac{\underline{\;催化剂\;}}{△}$2KCl+3O2↑,发生和收集装置为AC或AD(填字母).
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的②端口(填“①”或“②”)通入,F中发生的化学反应方程式为NaHCO3+HCl=2NaCl+H2O+CO2↑.
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3 $\frac{\underline{\;催化剂\;}}{△}$2KCl+3O2↑,发生和收集装置为AC或AD(填字母).
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的②端口(填“①”或“②”)通入,F中发生的化学反应方程式为NaHCO3+HCl=2NaCl+H2O+CO2↑.
9. 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
(5)立方ZnS晶体的密度为ρg•cm-3,其晶胞结构如图.Zn2+周围等距离且最近的Zn2+、S2-依次为12、4;ZnS晶胞中的晶胞参数a=$\root{3}{\frac{4×97}{ρ×{N}_{A}}}$cm(列出计算式).
 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
6.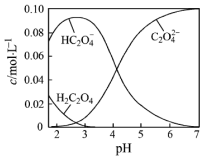 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
3.化学与生活、社会、环境等密切相关.下列有关说法中正确的是( )
| A. | 羽绒服中的鸭绒和羽绒棉的主要成分都是蛋白质 | |
| B. | 在食品袋中放入装有生石灰和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 含氮、磷的污水是很好的肥料,可直接排放到自然界水体中用于灌溉庄稼 | |
| D. | 煤燃烧排放的废气中含大量CO2、SO2,是形成“硫酸型”酸雨的主要原因 |
4.化学与生活密切相关.下列有关说法错误的是( )
| A. | SiO2、MgO熔点高,可用于制作耐高温仪器 | |
| B. | 纤维素属于多糖类物质,但不能作人类的营养物质 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | 天然气是可再生清洁能源,可用于工业制盐酸 |