题目内容
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、pH=4的0.1 mol?L-1的NaHC2O4溶液中:c(HC2O4-)>c (H2C2O4)>c(C2O42-) |
| B、0.1 mol?L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、常温下,等物质的量浓度的三种溶液:①(NH4)2SO4②NH4Cl ③(NH4)2Fe(SO4)2中c(NH4+):①<②<③ |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A、0.1 mol?L-1的NaHC2O4溶液的pH=4,该溶液显示酸性,说明草酸氢根离子的电离程度大于其水解程度;
B、根据碳酸氢钠溶液中电荷守恒和物料守恒进行分析;
C、醋酸钠、盐酸两溶液混合呈中性,c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(CH3COO-)+c(Cl-)=c(CH3COO-)+c(CH3COOH),即c(Cl-)=c(CH3COOH);
D、等物质的量浓度的三种溶液,①和③中铵离子浓度最大,其中③中铁离子水解显示酸性,抑制了铵离子水解,c(NH4+):①<③,而②中铵离子浓度最小.
B、根据碳酸氢钠溶液中电荷守恒和物料守恒进行分析;
C、醋酸钠、盐酸两溶液混合呈中性,c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(CH3COO-)+c(Cl-)=c(CH3COO-)+c(CH3COOH),即c(Cl-)=c(CH3COOH);
D、等物质的量浓度的三种溶液,①和③中铵离子浓度最大,其中③中铁离子水解显示酸性,抑制了铵离子水解,c(NH4+):①<③,而②中铵离子浓度最小.
解答:
解:A、NaHC2O4溶液显示酸性,说明了草酸氢根离子的电离程度大于其水解程度,溶液中c(H2C2O4)<c(C2O42-),故A错误;
B、0.1 mol?L-1的NaHCO3溶液中,由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),由物料守恒可知:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),根据以上关系可得:c(OH-)+c(CO32-)=c(H2CO3)+c(H+),故B错误;
C、两溶液混合呈中性,则c(OH-)=c(H+),由电荷守恒:c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(CH3COO-)+c(Cl-)=c(CH3COO-)+c(CH3COOH),即c(Cl-)=c(CH3COOH),故c(Na+)>c(Cl-)=c(CH3COOH),故C正确;
D、等物质的量浓度的①(NH4)2SO4 ②NH4Cl ③(NH4)2Fe(SO4)2三种溶液中,铵离子都只有部分水解,铵离子浓度最小的为②NH4Cl,而①③中,③中亚铁离子水解显示酸性,抑制了铵离子的水解,铵离子水解程度减小,铵离子浓度大于①,所以铵离子浓度关系为:②<①<③,故D错误;
故选C.
B、0.1 mol?L-1的NaHCO3溶液中,由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),由物料守恒可知:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),根据以上关系可得:c(OH-)+c(CO32-)=c(H2CO3)+c(H+),故B错误;
C、两溶液混合呈中性,则c(OH-)=c(H+),由电荷守恒:c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(CH3COO-)+c(Cl-)=c(CH3COO-)+c(CH3COOH),即c(Cl-)=c(CH3COOH),故c(Na+)>c(Cl-)=c(CH3COOH),故C正确;
D、等物质的量浓度的①(NH4)2SO4 ②NH4Cl ③(NH4)2Fe(SO4)2三种溶液中,铵离子都只有部分水解,铵离子浓度最小的为②NH4Cl,而①③中,③中亚铁离子水解显示酸性,抑制了铵离子的水解,铵离子水解程度减小,铵离子浓度大于①,所以铵离子浓度关系为:②<①<③,故D错误;
故选C.
点评:本题考查了溶液中离子浓度大小比较、盐的水解原理及其应用,题目难度中等,注意明确盐的水解原理,掌握比较溶液中离子浓度大小的方法,明确电荷守恒、物料守恒等比较离子浓度大小中应用.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
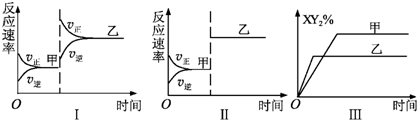

| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
下列实验装置或操作设计正确且能达到实验目的是( )
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |
下列图示的实验或操作正确的是( )
A、 鉴别Na2CO3和NaHCO3 |
B、 萃取振荡时放气 |
C、 转移溶液 |
D、 用酿制的米酒获取酒精 |
用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA |
| B、标准状况下,22.4LSO3含有的分子数为NA |
| C、1mol二氧化硅中含有的Si-O键数目为2NA |
| D、16.9 g BaO2晶体中阴、阳离子总数为0.2NA |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C、c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D、与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol.则下列叙述正确的是( )
| A、两种溶液的pH不相同 |
| B、它们分别与足量CaCO3反应时,放出的CO2一样多 |
| C、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| D、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1L0.25 mol/L的Na2SO4溶液中含氧原子个数为NA |
| B、12g石墨烯(单层)中含六元环的个数为0.5NA |
| C、78g苯含有碳碳双键数为3NA |
| D、电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
