题目内容
15.下列离子方程式改写成化学方程式正确的是( )| A. | Cu+2Ag+═Cu2++2Ag Cu+2AgCl═CuCl2+2 Ag | |
| B. | CO32-+2 H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Al3++3OH-═Al(OH)3↓ Al( NO3)3+3NH3•H2O═Al(OH)3↓+3NH4NO3 | |
| D. | H++OH-═H2O Ba(OH)2+2HNO3═Ba(NO3)2+2H2O |
分析 A.氯化银为沉淀,不能拆;
B.碳酸钡为沉淀,不能拆;
C.一水合氨为弱碱,不能拆;
D.Ba(OH)2+2HNO3═Ba(NO3)2+2H2O,反应实质氢离子与氢氧根离子反应生成水.
解答 解:A.Cu+2Ag+═Cu2++2Ag表示铜与可溶性银盐反应,氯化银为沉淀不能拆成离子形式,故A不选;
B.CO32-+2 H+═CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、二氧化碳和水,而碳酸钡为沉淀,不能拆,故B不选;
C.Al3++3OH-═Al(OH)3↓ 表示氢氧化铝和可溶性强碱反应,一水合氨为弱碱,不能拆,故C不选;
D.Ba(OH)2+2HNO3═Ba(NO3)2+2H2O,反应实质氢离子与氢氧根离子反应生成水,离子方程式:H++OH-═H2O,故D选;
故选D.
点评 本题考查了离子方程式书写正误判断,明确物质的性质、反应的实质是解题关键,注意化学式拆分,题目难度不大.

练习册系列答案
相关题目
5.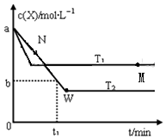 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |
3.从2mol/L的NaOH溶液中取出100mL,下列关于这100mL溶液的叙述中错误的是( )
| A. | 含NaOH 0.2mol | B. | 浓度2mol/L | ||
| C. | 含NaOH 4g | D. | 溶质的质量分数与原溶液相同 |
10. 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)环形玻璃搅拌棒的作用是使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致.
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8 kJ/mol.
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)环形玻璃搅拌棒的作用是使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致.
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
4.2016年10月17日,神州十一号飞船在酒泉卫星发射中心成功发射.根据太空的失重状况,下列化学实验在太空中无法完成的是( )
| A. | 过滤 | B. | 两种固体混合 | ||
| C. | 硫酸与氢氧化钠溶液的中和反应 | D. | 蒸发 |
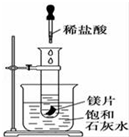 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: