题目内容
海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
(1)多级闪蒸法是目前“海水淡化”的主要技术.该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水.由此可判断多级闪蒸法是 (填“物理变化”或“化学变化”).
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 .
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品.在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代.

①写出两电极的反应式:阳极 ,阴极 .
②石棉隔膜的作用是 .离子交换膜电解槽中⑥、⑦分别是 、 .
(1)多级闪蒸法是目前“海水淡化”的主要技术.该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水.由此可判断多级闪蒸法是
(2)利用海水晒盐的原理是
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品.在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代.

①写出两电极的反应式:阳极
②石棉隔膜的作用是
考点:海水资源及其综合利用,常见化学电源的种类及其工作原理
专题:电化学专题,元素及其化合物
分析:(1)根据蒸馏法的原理;
(2)食盐的溶解度受温度影响变化不大,利用海水晒盐,就是把海水引入海滩,借助日光和风力使水分蒸发,得到分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后可以冶炼金属,据此进行分析判断;
(3)①用惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气;
②Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
(2)食盐的溶解度受温度影响变化不大,利用海水晒盐,就是把海水引入海滩,借助日光和风力使水分蒸发,得到分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后可以冶炼金属,据此进行分析判断;
(3)①用惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气;
②Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
解答:
解:(1)在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,操作方法是蒸馏方法,蒸馏是利用物质的沸点不同进行分离,沸点属于物理性质,故答案为:物理变化;
(2)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于工业上冶炼金属钾和镁;
故答案为:蒸发、结晶; 工业上冶炼金属钾和镁;
(3)①用惰性电极电解饱和食盐时,阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,发生的方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生的方程式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过;
电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:分成阴、阳两极室,阻止气体通过;NaOH溶液;Na+;
(2)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于工业上冶炼金属钾和镁;
故答案为:蒸发、结晶; 工业上冶炼金属钾和镁;
(3)①用惰性电极电解饱和食盐时,阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,发生的方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生的方程式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过;
电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:分成阴、阳两极室,阻止气体通过;NaOH溶液;Na+;
点评:本题主要考查了食盐制备、氯碱工业和金属镁的制备,掌握电解饱和食盐水的反应原理和海水中镁的提取方法是解答的关键,题目难度中等.

练习册系列答案
相关题目
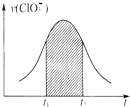 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是( )
| A、氧原子的杂化类型发生了改变 |
| B、微粒的形状发生了改变 |
| C、微粒的化学性质发生了改变 |
| D、微粒中的键角发生了改变 |



 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3