题目内容
当电解饱和盐水时,如果有0.1mol电子发生转移,在标准状况下产生气体的总体积是( )
| A、8.96L |
| B、4.48L |
| C、44.8L |
| D、2.24L |
考点:电解原理
专题:电化学专题
分析:依据电解饱和食盐水的化学方程式计算得到氢气和氯气的物质的量并计算其体积.
解答:
解:电解饱和食盐水发生的反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,该反应转移2mol电子,当反应中电子转移0.1mol电子,则反应会生成氯气、氢气各0.05mol,共产生0.1mol气体,体积是2.24L.
故选D.
| ||
故选D.
点评:本题考查学生电解池中电池反应的书写以及电子转移和物质的量之间的关系,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
从海带中提取碘单质有如下实验步骤:
①向滤液中通入足量的C12,得碘的水溶液;
②将干海带烧成灰,用蒸馏水浸泡后过滤;
③将碘的四氯化碳溶液分离得到单质碘;
④向水中加入四氯化碳萃取碘.
正确的操作顺序是( )
①向滤液中通入足量的C12,得碘的水溶液;
②将干海带烧成灰,用蒸馏水浸泡后过滤;
③将碘的四氯化碳溶液分离得到单质碘;
④向水中加入四氯化碳萃取碘.
正确的操作顺序是( )
| A、①②③④ | B、①③④② |
| C、②①④③ | D、④③②① |
下列说法正确的是( )
| A、所有反应物的键能之和小于所有生成物的键能之和的反应为放热反应 |
| B、所有反应物的总能量小于所有生成物的总能量的反应为放热反应 |
| C、中和热与化学反应方程式的计量数成正比 |
| D、葡萄糖在人体内与氧气的反应为吸热反应 |
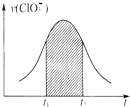 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |
下列反应中必须加入还原剂才能进行的是( )
| A、ClO2→Cl- |
| B、Zn→Zn2+ |
| C、H2→H2O |
| D、CuO→CuCl2 |
以下说法正确的是( )
| A、电解饱和食盐水,阳极反应式一定为:2Cl--2e-=Cl2↑ |
| B、无论是原电池还是电解池中,电子均不能通过电解质溶液 |
| C、电解精炼铜时,粗铜作阴极 |
| D、为保护地下钢管不受腐蚀,可使它与铜板相连 |
某温度下纯水中c(H+)=10-6mol/L,此温度下pH=5的盐酸与pH=9的氢氧化钡溶液混合后pH=7,则氢氧化钡溶液与盐酸之比为( )
| A、2:99 | B、1:1 |
| C、1:99 | D、1:100 |


