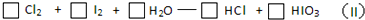题目内容
0.1mol有机物A重6.2g,在O2中完全燃烧后生成CO2和H2O,产物通过足量的浓硫酸,浓硫酸的质量增加5.4g,再通过碱石灰,碱石灰的质量增加8.8g;若6.2g的A与足量的钠反应能产生0.1mol H2,试确定该有机物A的分子式和结构简式.
考点:有机物实验式和分子式的确定
专题:烃及其衍生物的燃烧规律
分析:根据0.1mol有机物A重6.2g,求出摩尔质量为62g/mol,浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式.
解答:
解:浓硫酸增重可知水的质量为10.8g,可计算出n(H2O)=
=0.3mol,n(H)=0.6mol,m(H)=0.6g;使碱石灰增重8.8g,可知二氧化碳质量为8.8g,n(C)=n(CO2)=
=0.2mol,m(C)=2.4g,m(C)+m(H)=3g,有机物的质量为6.2g,所以有机物中氧的质量为3.2g,n(O)=
=0.2mol,
n(C):n(H):n(O)=0.2mol:0.6mol:0.2mol=2:6:2,即实验式为C2H6O2,相对分子质量为62,
所以分子式为C2H6O2,该物质已饱和,不含有羧基,只能使羟基或醚键,6.2g的A即0.1mol与足量的钠反应能产生0.1mol H2,所以一个分子中含有2个羟基,结构简式为:CH2OHCH2OH;
答:该有机物A的分子式和结构简式分别为C2H6O2、CH2OHCH2OH.
| 5.4g |
| 18g/mol |
| 8.8g |
| 44g/mol |
| 3.2g |
| 16g/mol |
n(C):n(H):n(O)=0.2mol:0.6mol:0.2mol=2:6:2,即实验式为C2H6O2,相对分子质量为62,
所以分子式为C2H6O2,该物质已饱和,不含有羧基,只能使羟基或醚键,6.2g的A即0.1mol与足量的钠反应能产生0.1mol H2,所以一个分子中含有2个羟基,结构简式为:CH2OHCH2OH;
答:该有机物A的分子式和结构简式分别为C2H6O2、CH2OHCH2OH.
点评:本题考查学生元素守恒法确定有机物的最简式和结构,注意质量守恒的应用和官能团的性质,难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
心脏起搏器电源-锂碘电池的电池反应为:2Li(s)+I2(s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则下列说法正确的是( )
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则下列说法正确的是( )
A、△H=
| ||||
B、△H=
| ||||
C、△H=
| ||||
D、△H=
|
实现下列转化,一般需要加入氧化剂的是( )
| A、NaCl→HCl |
| B、FeCl2→FeCl3 |
| C、HCl→H2 |
| D、Cl2→HCl |