题目内容
2.完成下列内容:(1)AsH3是一种很强的还原剂.室温下,它能在空气中自燃,其氧化产物为As2O3写出该反应的化学方程式:2AsH3+3O2=As2O3+3H2O.
(2)白磷在一定条件下可被HClO3的水溶液氧化,生成磷的最高价态化合物,而氯元素被还原为最低价态.写出该反应的化学方程式:3P4+10HClO3+18H2O=10HCl+12H3PO4.
(3)稀硫酸与铜不反应,但在稀硫酸中加H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:H2O2+Cu+2H+=Cu2++2H2O.
(4)配平:3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O.
分析 (1)AsH3是一种很强的还原剂,与氧气反应生成As2O3与水;
(2)由题给信息可知,白磷(P4)与HClO3的水溶液反应生成H3PO4和HCl;
(3)酸性条件下,过氧化氢和铜反应生成水和铜离子;
(4)反应中Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,N元素化合价由+5价降低为NO中+2价,共降低3价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒配平.
解答 解:(1)AsH3与氧气反应生成As2O3和水,反应的方程式为2AsH3+3O2=As2O3+3H2O,
故答案为:2AsH3+3O2=As2O3+3H2O;
(2)由题给信息可知白磷与HClO3的水溶液反应生成H3PO4和HCl,反应的方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,
故答案为:3P4+10HClO3+18H2O=10HCl+12H3PO4;
(3)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水,反应的离子反应为:H2O2+Cu+2H+=Cu2++2H2O,
故答案为:H2O2+Cu+2H+=Cu2++2H2O;
(4)反应中Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,N元素化合价由+5价降低为NO中+2价,共降低3价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒配平方程式为:3Cu2S+22HNO3=6 Cu(NO3)2+10NO↑+3H2SO4+8H2O,
故答案为:3;22;6;10;3;8.
点评 本题考查化学方程式书写、氧化还原反应方程式配平等,掌握方程式配平常用方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.根据表格中所给的相关数据回答问题
(1)SiCl4的晶体类型是分子晶体;碳化铝的晶体类型是原子晶体.
(2)能否用电解熔融AlCl3的方法来制取铝?为什么?不能(填能或否),理由是AlCl3是分子晶体,熔融时不能导电.
| NaCl | AlCl3 | SiCl4 | 碳化铝 | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2200℃ |
(2)能否用电解熔融AlCl3的方法来制取铝?为什么?不能(填能或否),理由是AlCl3是分子晶体,熔融时不能导电.
7.在标准状况下进行甲、乙、丙三组实验.三组实验均各取30mL同浓度的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?乙(填“甲”或“乙”).理由是因甲反应后的溶液中再加合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应或有剩余,则产生的氢气应为$\frac{280}{255}$385mL=423mL>336mL,故说明乙中盐酸不足.
(2)依据题中数据计算出盐酸的物质的量浓度,求得的盐酸的物质的量浓度为1mol/L.
(3)依据题中数据求合金中Mg、Al的物质的量之比,求得的Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)依据题中数据计算出盐酸的物质的量浓度,求得的盐酸的物质的量浓度为1mol/L.
(3)依据题中数据求合金中Mg、Al的物质的量之比,求得的Mg、Al物质的量之比为1:1.
14.下列物质与危险化学品标志的对应关系正确的是( )
| A. |  乙醇 | B. |  金属钠 | C. |  天然气 | D. |  乙酸 |
12.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | 均溶于水 | B. | 受热均易分解 | ||
| C. | 均为钠盐 | D. | 均能与盐酸反应放出CO2 |
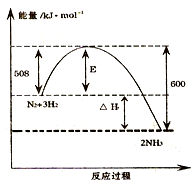 如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.