��Ŀ����
13���Ķ���������������Ϣ���ش����⣺��һ������50Kg�Ľ����˺���2g����2g���������в����Ե��ʽ�������ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڣ����������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬�����ӵ������Σ�����������������ά����C����ʹʳ���е������ӻ�ԭ���������ӣ������������գ�
�����������ĺ�ˮ����һ����ϸ����������ȡ��ˮ�е��������ӣ�����øΪ��������ת������ǵ�Ƥ�ʣ�������Fe2O3����ʾ���е���������������������γ����÷�Ӧ����һ�ַ�Ӧ����CO2����Ӧ��CO2ת����л����ȩ������CH2O��ʾ����
���⣺
�����������Ϣ�ֱ�����������ںͺ�ˮ�е����������������ӣ��������ĸۻ�����ת������ʵ��������;��
��1�������������Fe2+��Fe3+��ת������˵���������Ӿ��л�ԭ�ԣ������Ӿ��������ԣ�
��2������ά����C������ʹʳ���е�Fe3+��ԭ��Fe2+����仰ָ��ά����C�ǻ�ԭ�������л�ԭ�ԣ�
��3���г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ�ᣨ��Ҫ�ɷ������ᣩ��������ת���������Σ��˷�Ӧ�Ļ�ѧ����ʽΪFe+2HCl=FeCl2+H2�������ӷ���ʽΪ��Fe+2H+=Fe2++H2����
��4���ڢ�����Ϣ�е�CO2����������д�����е����ӷ���ʽCO2+4Fe2++5H2O=CH2O+2Fe2O3+8H+��
���� ��1��Fe2+��Fe3+��ת����FeԪ�صĻ��ϼ����ߣ����ֻ�ԭ�ԣ�FeԪ�صĻ��ϼ۽��ͣ����������ԣ�
��2��ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+��FeԪ�صĻ��ϼ۽��ͣ���ά����C��ijԪ�صĻ��ϼ����ߣ�
��3��Fe�����ᷴӦ�����Ȼ�������������
��4����Ӧ��CO2ת����л����ȩ��CԪ�صĻ��ϼ۽��ͣ���FeԪ�صĻ��ϼ����ߣ�
��� �⣺��1��Fe2+��Fe3+��ת�����������Ӿ��л�ԭ�ԣ������Ӿ��������ԣ��ʴ�Ϊ����ԭ��������
��2��ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+��FeԪ�صĻ��ϼ۽��ͣ���ά����C��ijԪ�صĻ��ϼ����ߣ���ά����C���л�ԭ�ԣ�����ԭ�����ʴ�Ϊ����ԭ����ԭ��
��3��Fe�����ᷴӦ�����Ȼ������������������ķ�ӦΪFe+2HCl=FeCl2+H2�������ӷ�ӦΪFe+2H+=Fe2++H2�����ʴ�Ϊ��Fe+2HCl=FeCl2+H2����Fe+2H+=Fe2++H2����
��4����Ӧ��CO2ת����л����ȩ��CԪ�صĻ��ϼ۽��ͣ���FeԪ�صĻ��ϼ����ߣ���1����2����3����1�֣�
��4����Ӧ��CO2ת����л����ȩ��CԪ�صĻ��ϼ۽��ͣ���FeԪ�صĻ��ϼ����ߣ��������̼����������������������ԭ��Ӧ�����ӷ�ӦΪCO2+4Fe2++5H2O=CH2O+2Fe2O3+8H+��
�ʴ�Ϊ��������CO2+4Fe2++5H2O=CH2O+2Fe2O3+8H+��
���� ���⿼��������ԭ��Ӧ��Ϊ��Ƶ���㣬����ϰ���е���Ϣ����Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�����Ǩ��Ӧ�������Ŀ��飬��Ŀ�ѶȲ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� |  ��ɢϵ�ķ��� | |
| B�� |  ����ϡ�� | |
| C�� | 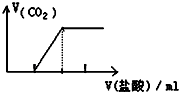 ��Na2CO3��Һ����ε������� | |
| D�� | 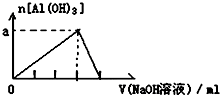 ��AlCl3��Һ�еμӹ�����NaOH��Һ |
| A�� | �ۢ� | B�� | �٢ۢ� | C�� | �� | D�� | ȫ�� |
��1�����й�����ˮ��������ȷ����aef����д��ţ���
a����ˮ�д������ֵ���ƽ��
b������ˮ��ͨ��SO2����Ư������ǿ
c������ˮ��ͨ��������$\frac{c��{H}^{+}��}{c��ClO-��}$��С
d����ˮϡ����ˮ����Һ�е���������Ũ�Ⱦ���С
e����ˮϡ����ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ�
f������ˮ�м���������NaOH��������c��Na+��=c��Cl-��+c��ClO-��
��2�������ڹ�ҵ�����ż���㷺����;����ҵ��ͨ���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+Cl2��+H2�����ö��Ե缫���100mL����ʳ��ˮ��������������״����11.2mL���壬������Һ����ı仯ʱ��������Һ��pH=12��
��3�������£���֪25��ʱ�й�����ĵ���ƽ�ⳣ����
| ���ữѧʽ | HClO | H2CO3 |
| ����ƽ�ⳣ�� | K=4.7��10-8 | K1=4.3��10-7��K2=5.6��10-11 |
| A�� | �����ᳫ������ʯȼ����Ϊ��Դ | |
| B�� | �з����ʹ��������ʯ�ͺ�ú�и���ֵ�ȼ���� | |
| C�� | ��ʯȼ�����ڿ�������Դ����Ӱ��ɳ�����չ | |
| D�� | ����Ӧ�����ܿ�������Դ��ȡ����ʯ��Դ |
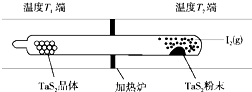 ��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã�
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã�