题目内容
11.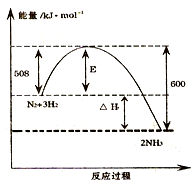 如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:(1)写出氮气与氢气合成氨的热化学反应方程式:N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.(2)已知在常温常压下:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
H2O(g)═H2O(l)△H=-c kJ•mol-1
则,CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{1}{2}$(b-a-4c)kJ•mol-1.
分析 (1)由图可知,1mol氮气与3mol氢气反应生成2mol氨气放出的热量为600kJ-508kJ=92kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),焓变也进行相应计算.
解答 解:(1)由图可知,1mol氮气与3mol氢气反应生成2mol氨气放出的热量为600kJ-508kJ=92kJ,该反应热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-92kJ/mol,
2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)  2NH3(g)△H=-92kJ/mol;
2NH3(g)△H=-92kJ/mol;
(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),则△H=$\frac{1}{2}$(b-a-4c) kJ/mol,
故答案为:$\frac{1}{2}$(b-a-4c).
点评 本题考查热化学方程式书写、应用盖斯定律计算反应热,难度不大,注意对盖斯定律的理解与应用.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
1.下列物质①NaHCO3 ②Al ③Al2O3 ④Al(OH)3中,既能与盐酸反应,又能与NaOH溶液反应的是( )
| A. | ③④ | B. | ①③④ | C. | ③ | D. | 全部 |
6.短周期元素X、Y、Z、W在周期表中的位置关系如表所示.已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
(1)X元素在元素周期表中的位置是第二周第ⅣA族.
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为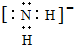
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为
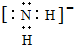
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
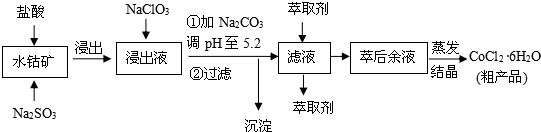
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH表:(金属离子浓度为:0,01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH表:(金属离子浓度为:0,01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
3.化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”.下列观点正确的是( )
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
20.下列物质属于离子化合物的是( )
| A. | CO2 | B. | CaO | C. | H2O2 | D. | H2SO4 |
1.下列盛放试剂的方法,错误的是( )
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |