题目内容
在557度的密闭容器中进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),若CO起始浓度为2.0mol/L,水蒸气起始浓度为3.0mol/L,达到平衡后,测得CO2浓度为1.2mol/L,求反应的平衡常数及CO(g)和H2O(g)的平衡转化率.
考点:化学平衡的计算
专题:化学平衡专题
分析:利用三段式计算平衡时各组分的平衡浓度,将平衡浓度代入平衡常数表达式k计算.根据转化率=
×100%计算;
| 浓度变化量 |
| 起始浓度 |
解答:
解:CO起始浓度为2mol?L-1,水蒸气的起始浓度为3mol?L-1,达到平衡后,CO2平衡浓度为1.2mol?L-1,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
该温度下平衡常数k=
=1,
CO的转化率=
×100%=60%,
H2O(g)的转化率=
×100%=40%,
答:K=1,CO(g)和H2O(g)的平衡转化率分别为60%和40%.
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
该温度下平衡常数k=
| 1.2×1.2 |
| 0.8×1.8 |
CO的转化率=
| 1.2mol/L |
| 2mol/L |
H2O(g)的转化率=
| 1.2mol/L |
| 3mol/L |
答:K=1,CO(g)和H2O(g)的平衡转化率分别为60%和40%.
点评:本题考查化学平衡的有关计算、平衡常数计算,比较基础,注意三段式解题法的利用.

练习册系列答案
相关题目
朝核问题是目前全球关注的热点,已知
U是一种重要的核工业原料,下列有关
U说法正确的是( )
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
NO2与水的反应中,作还原剂和氧化剂的NO2物质的量之比为( )
| A、1:3 | B、3:1 |
| C、2:1 | D、1:2 |
 ; ⑥CH3 (CH2)3 CH3和
; ⑥CH3 (CH2)3 CH3和
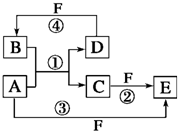 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).