题目内容
13.下列物质的性质比较,正确的是( )| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.金属性越强,对应最高价水化物的碱性越强;
C.同周期从左向右非金属性增强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.非金属性Cl>S,对应最高价含氧酸的酸性为H2SO4<HClO4,故A错误;
B.金属性K>Na,对应最高价水化物的碱性为NaOH<KOH,故B错误;
C.同周期从左向右非金属性增强,则非金属性:P<S<Cl,故C错误;
D.非金属性F>Cl>S,对应氢化物的稳定性为HF>HCl>H2S,故D正确;
故选D.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
3.合成人造羊毛: 的单体正确的是( )
的单体正确的是( )
 的单体正确的是( )
的单体正确的是( )| A. |  | B. | CH3-CN | C. | CH2═CHCN | D. | CH2═HCN |
1.下列有关环境问题的说法正确的是( )
| A. | 臭氧的体积分数超过10-4%的空气有利于人体健康 | |
| B. | pH在5.6~7.0之间的雨水通常称为酸雨 | |
| C. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
8.下列过程中共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 食盐熔化 | D. | 电解水生成氢气和氧气 |
18.对C、N、O元素的有关比较表述不正确的是( )
| A. | 氢化物稳定性:CH4<NH3<H2O | B. | 第一电离能:C<N<O | ||
| C. | 电负性:C<N<O | D. | 氢化物沸点:CH4<NH3<H2O |
5.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
2.在一个固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是( )
| A. | C的质最不再改变 | |
| B. | 物质的最浓度c(A):c(B):c(C):c(D)=m:n:p:q | |
| C. | 各组分浓度不再改变 | |
| D. | 单位时间内m molA断键,同时pmolC也断键 |
3.有机物 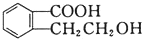 可以通过不同的反应得到①
可以通过不同的反应得到①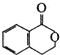 、②
、②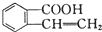 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )
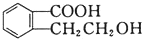 可以通过不同的反应得到①
可以通过不同的反应得到① 、②
、②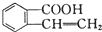 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )| A. | 酯化、取代、缩聚 | B. | 酯化、消去、缩聚 | C. | 取代、消去、加聚 | D. | 取代、消去、酯化 |
