题目内容
(15分)(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。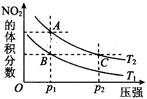
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: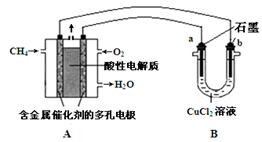
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
(1)①弱电解质(1分) ②B(2分) ③A D(2分)(2)②>①>④>③(2分)
(3)-1185 kJ·mol-1(2分) (4)④(2分)
(5)CH4 —8e— + 2H2O=CO2 + 8H+(2分) 6.4(2分)
解析试题分析:(1)①25℃时,0.1 mol·L-1的HA溶液,若HA是强酸,则c(H+)/c(OH-)=1012,实际上则c(H+)/c(OH-)=1010,所以HA是弱酸,是弱电解质;②A.HA是弱酸,加水稀释促进电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:n(H+)/n(HA)=c(H+)/c(HA),其比值增大,错误;B.HA是弱酸,加水稀释促进电离,溶液中A—的物质的量增大,HA的物质的量减小,相同溶液中:n(HA)/n(A-)=c(HA)/c(A-),其比值减小,正确;C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,错误;D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,错误;选B;③A.若溶液M呈中性,则c(H+)=c(OH-)=1×10-7mol?L-1,则c(H+)+c(OH-)=2×10-7mol?L-1,正确;B.若V1=V2,HA远过量,溶液M的pH小于7,错误;C.HA为弱酸,M溶液呈酸性,则V1不一定大于V2,错误;D.HA为弱酸,溶液呈碱性,V1一定小于V2,正确;选:AD;(2)②AgCl分别放入100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制氯化银沉淀溶解,③AgCl分别放入100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④AgCl分别放入100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为:②>①>④>③;(3)单质硫的燃烧热为296kJ?mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ?mol-1,而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,则SO2(g)+1/2O2(g)=SO3(g)△H=-99kJ?mol-1,由盖斯定律可得:S(s)+3/2O2(g)=SO3(g)△H=-296kJ?mol-1+(-99kJ?mol-1)=-395kJ?mol-1,所以S(s)生成3mol SO3(g)的△H为-395kJ?mol-1×3=-1185 kJ?mol-1;(4)2NO2(g) N2O4(g) ΔH < 0,该反应为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大;增大压强,化学平衡正向移动,NO2的体积分数减小。①由图象可知,A、C两点均在温度为T2的等温线上,C的压强大,则A、C两点的反应速率:A<C,错误;②由图象可知,C的压强大,体积小,则C各物质的浓度大,则a、c两点气体的颜色:A浅,C深,错误;③B、C两点的气体的体积分数相等,平均分子质量:B=C,错误;④升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,正确;选④;(5)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+;②B为电解池,铜离子发生还原反应,在阴极析出,转移0.2mol电子,析出铜的物质的量为0.1mol,质量为6.4g。
N2O4(g) ΔH < 0,该反应为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大;增大压强,化学平衡正向移动,NO2的体积分数减小。①由图象可知,A、C两点均在温度为T2的等温线上,C的压强大,则A、C两点的反应速率:A<C,错误;②由图象可知,C的压强大,体积小,则C各物质的浓度大,则a、c两点气体的颜色:A浅,C深,错误;③B、C两点的气体的体积分数相等,平均分子质量:B=C,错误;④升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,正确;选④;(5)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+;②B为电解池,铜离子发生还原反应,在阴极析出,转移0.2mol电子,析出铜的物质的量为0.1mol,质量为6.4g。
考点:考查电解质的电离、沉淀溶解平衡、平衡图像、反应热的计算及电化学。

氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常数K | K1 | K2 |
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
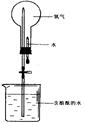
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)﹥c(NH4+) b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现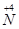 向
向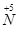 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 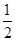 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 | |  |  2.70×10-3 2.70×10-3 | |
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
(12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
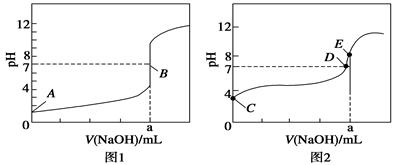
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
(15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
A. | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
 (3)已知在常温常压下:
(3)已知在常温常压下:
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示: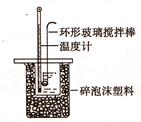
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H= (取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
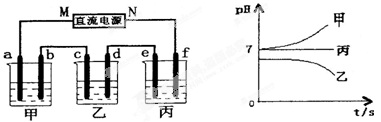
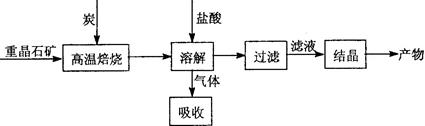
 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
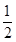 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2