题目内容
Ⅰ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题: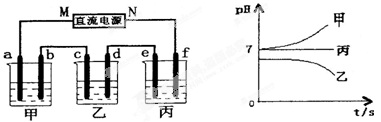
(1)在甲中烧杯中滴加酚酞, 极(填a或b)附近溶液会变红。
(2)写出乙烧杯中发生反应的化学方程式 。
(3)电极f上发生的电极反应式为 。
(4)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
Ⅱ.工业上利用BaSO4制备BaCl2的工艺流程如下: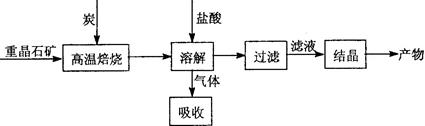
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验。
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S。Na2S水溶液显碱性的原因是 。(用离子方程式表示)
(2)已知有关反应的热化学方程式如下:
BaSO4(s) +4C(s) 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
C(s) +CO2(g) 2CO(g) △H2 = +172.5kJ/mol ②
2CO(g) △H2 = +172.5kJ/mol ②
则反应BaSO4(s) +2C(s) 2CO2(g) + BaS(s) △H3 =
2CO2(g) + BaS(s) △H3 =
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是 。

解析试题分析:Ⅰ在电解时乙中c电极质量增加,说明c电极为阴极,则直流电源M极为负极,N极为正极。由于开始时溶液的PH值甲、丙是7,二者应为强酸强碱盐;乙的PH小于7,为强酸弱碱盐,结合已知条件,含Cu2+。(1)随着电解的进行,甲的PH逐渐增大,说明H2O和电解质都发生了反应,甲为氯化物。H+在阴极a电极放电,由于破坏了附近的水的电离平衡,其附近的OH-浓度增大,所以滴加酚酞a电极附近会变红,Cl-在阳极b放电(2);乙的PH逐渐减小,说明OH-放电,含有含氧酸根离子SO42-、乙是CuSO4溶液.乙烧杯的化学方程式是:
(3)丙在电解过程中PH不变,一直是7,说明丙为活泼金属的含氧酸盐,电解的实质是水,丙为Na2SO4溶液.在f极OH-放电,电极反应式为:4OH-—4e-=O2↑+2H2O。(4)根据电解方程式可知要使丙烧杯中溶液恢复到原来的状态,应加入两电极的产物反应得到的物质即可,即加入CuO,其质量为10克。
Ⅱ(1)Na2S是强碱弱酸盐, S2-水解消耗水电离产生的H+,最终整个溶液中c(OH-)〉c(H+),呈碱性,离子方程式为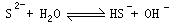
(2)、①-②×2得:该反应方程式,△H3=△H1-2△H2="+571.2" kJ/mol-2×172.5 kJ/mol="+226.2" kJ/mol.
(3)该反应为吸热反应,碳燃烧放热可为反应提供能量,所以要加入过量的炭,并且要不断通入空气。
考点:考查盐的电解、盐的水解、反应热等知识。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案Ⅰ.恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。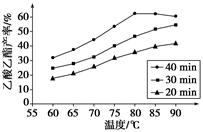
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)平衡常数为K;
2CO(g)平衡常数为K;①C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;则K、K1、K2之间的关系是______________________________________。
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
下列说法正确的是_______。
| A.ΔH=-92.4kJ/mol |
| B.使用催化剂会使E1的数值增大 |
| C.为了提高转化率,工业生产中反应的浓度越低越好 |
| D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB |
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为
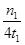 mol/(L·min)
mol/(L·min)(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的
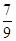 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式_____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1molN2实际提供460kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
 CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。 CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
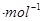 .
. 、一283.0 kJ
、一283.0 kJ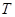 、
、 均大于300℃):
均大于300℃):
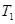 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
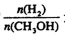 增大
增大 4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应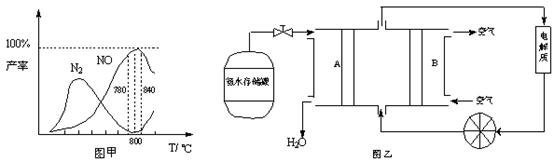
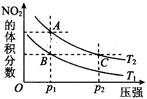
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。