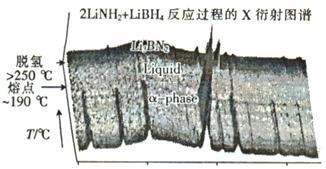
题目内容
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现 向
向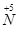 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 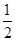 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 | |  |  2.70×10-3 2.70×10-3 | |
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
(1)4NH3+5O2 4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
(2)2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1(2分)
①4.25×10-4mol/(L·s) (2分) ②5000(2分) ③CD(2分,各1分)
解析试题分析:
本题是利用NH3制备HNO3一个工业上的应用。
(1)NH3的催化氧化反应方程式4NH3+5O2 4NO+6H2O,
4NO+6H2O,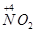 到
到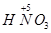 ,工业上是将NO2、过量O2通入H2O中,使得
,工业上是将NO2、过量O2通入H2O中,使得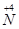 全被氧化又同时不产生污染性气体。
全被氧化又同时不产生污染性气体。
(2)根据盖斯定律将上式×2—下式即可得到2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1
注意热化学方程式的书写规范
v(CO)= 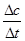 =4.25×10-4mol/(L·s) 注意单位书写
=4.25×10-4mol/(L·s) 注意单位书写
计算K的值,根据K的表达式:K=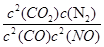 ,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
CD都可使平衡正向移动,反应物转化率增大,A和B选项平衡不移动,转化率不变
考点:化学平衡(化学反应速率,转化率,K的计算,盖斯定律)

Ⅰ.恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) 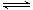 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。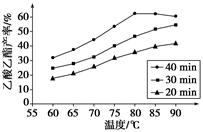
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) 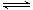 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
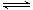 2CO(g)平衡常数为K;
2CO(g)平衡常数为K;①C(s)+H2O(g)
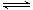 CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;②CO(g)+H2O(g)
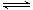 H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;则K、K1、K2之间的关系是______________________________________。
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。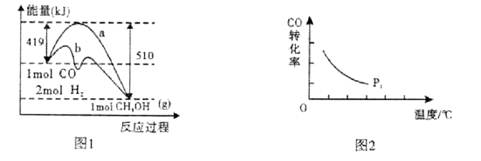
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol?L-1 | 等质量催化剂的 比表面积/m2?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | | | 124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
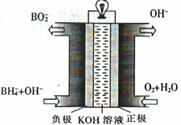
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 浓度/mol·L-1 浓度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B. 2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在下图中画出30min至40min的变化曲线。

 4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。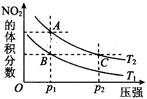
 2NH3 (g) ΔH ="c" kJ? mol-1
2NH3 (g) ΔH ="c" kJ? mol-1