题目内容
氯化铵溶液中离子浓度从大到小排列正确的是( )
| A、NH4+、H+、OH-、Cl- |
| B、Cl-、NH4+、H+、OH- |
| C、H+、Cl-、NH4+、OH- |
| D、Cl-、NH4+、OH-、H+ |
考点:离子浓度大小的比较
专题:
分析:氯化铵溶液中铵根离子水解显酸性,NH4Cl溶液显酸性,水解离子方程式为:NH4++H2O=NH3?H2O+H+;根据电荷守恒判断溶液中各离子浓度大小.
解答:
解:氯化铵溶液中,铵根离子部分水解,则氯离子浓度最大大,水解显酸性,则c(H+)>c(OH-),且显性离子大于隐性离子,则溶液中离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故选B.
故选B.
点评:本题考查离子浓度大小的比较,明确氯化铵为强酸弱碱盐及铵根离子的水解是解答本题的关键,注意显性离子大于隐性离子,题目难度不大.

练习册系列答案
相关题目
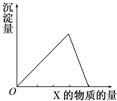 把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )
把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )| A、X为CO2,Y为Ca(OH)2 |
| B、X为NH3?H2O,Y为AlCl3 |
| C、X为NaOH,Y为AlCl3 |
| D、X为HCl,Y为Na[Al(OH)4] |
在配制一定物质的量浓度的溶液时,不会用到的仪器是( )
A、 烧杯 |
B、 烧瓶 |
C、 容量瓶 |
D、 胶头滴管 |
下列物质中,能使石蕊试液褪色的是( )
| A、二氧化碳 | B、氯气 |
| C、氧化钠 | D、氯化氢 |
已知25℃时,KHF=7.2×10-4 KHCN=4.9×10-10 KHNO2=4.6×10-4 KCH3COOH=1.8×10-5则相同浓度的上述溶液中溶质分子浓度最大的是( )
| A、HF |
| B、HCN |
| C、HNO2 |
| D、CH3COOH |
下列关于氢氧化铁胶体叙述不正确的是( )
| A、鉴别氢氧化铁胶体和氯化钠溶液用丁达尔效应 |
| B、向氢氧化铁胶体中加入硫酸溶液现象是先沉淀后沉淀消失 |
| C、除去氢氧化铁胶体中的铁离子用渗析的方法 |
| D、制备氢氧化铁胶体用氯化铁溶液和氢氧化钠溶液混合制取 |