题目内容
5. 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.(1)铁元素位于元素周期表中的第Ⅷ族,在水溶液中常以Fe2+、Fe3+的形式存在,其中Fe3+更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为sp3杂化.
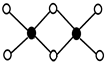
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示.1mol该分子中含2NA 个配位键,该分子否(填“是”或“否”)平面型分子.
(4)Al单质为面心立方晶体,其晶胞的边长a=0.405nm,列式表示Al单质的密度:2.7g•cm-3.
分析 (1)Fe元素原子核外电子数为26,根据能量最低原理书写其电子排布式,据此确定在周期表中位置;Fe3+离子3d为半满稳定状态,比较稳定;
(2)NaBH4中B原子价层电子对数为4+$\frac{3+1-1×4}{2}$=4,杂化轨道数目为4;
(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4;
(4)根据均摊法计算晶胞中Al原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Fe元素原子核外电子数为26,根据能量最低原理,其电子排布式为1s22s22p63s23p63d64s2,在周期表中位于第Ⅷ族,Fe3+离子3d为半满稳定状态,能量较低,比较稳定;
故答案为:Ⅷ;Fe3+;
(2)NaBH4中B原子价层电子对数为4+$\frac{3+1-1×4}{2}$=4,杂化轨道数目为4,其杂化方式为:sp3杂化,
故答案为:sp3杂化;
(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子,
故答案为:2NA;否;
(4)Al单质为面心立方晶体,晶胞中Al原子数目为8×$\frac{1}{8}$+5×$\frac{1}{2}$=4,晶胞质量为4×$\frac{4×27}{6.02×1{0}^{23}}$g,其晶体参数a=0.405nm,则晶胞密度为ρ=$\frac{4×27}{{6.02×{{10}^{23}}×(0.405×{{10}^{-7}}{)^3}}}=2.7g/c{m^3}$,
故答案为:2.7.
点评 本题是对物质结构与性质的考查,涉及微粒稳定性的判别、杂化方式与空间构型判断、晶胞计算等,注意中学常见晶胞结构,题目难度中等.

| A. | Br | B. | Rb | C. | S | D. | P |
| A. | 若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 | |
| B. | 在实验室中使用金属钠时若不慎着火,可立即用细沙灭火 | |
| C. | 用带有玻璃塞的玻璃瓶盛放NaOH溶液 | |
| D. | 测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上 |
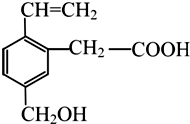 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
| A. | 只有①④ | B. | 只有①④⑤ | C. | ①②③④ | D. | 全部 |
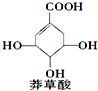 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有2种官能团 | |
| B. | 在水溶液中羧基和羟基均能电离出H+ | |
| C. | 分子式为C7H6O5 | |
| D. | 可发生加成和取代反应 |
 在水溶液中存在平衡:
在水溶液中存在平衡: 当
当 与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )
与 CH3CH2OH发生酯化反应时,不可能生成的产物是( )| A. |  | B. |  | C. | H2O | D. | H218O |

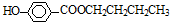 )可用作防腐剂,对酵母菌和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
)可用作防腐剂,对酵母菌和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线: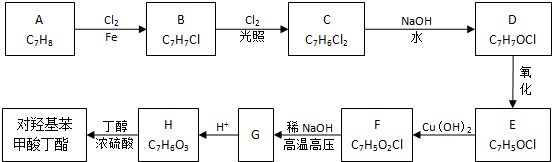
 +2Cu(OH)2 $\stackrel{△}{→}$
+2Cu(OH)2 $\stackrel{△}{→}$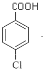 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;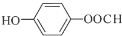 ,其核磁共振氢谱中不同化学环境的氢的峰面积比为1:2:2:1,它与足量NaOH溶液反应的方程式为
,其核磁共振氢谱中不同化学环境的氢的峰面积比为1:2:2:1,它与足量NaOH溶液反应的方程式为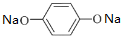 +HCOONa+2H2O.
+HCOONa+2H2O.