题目内容
5.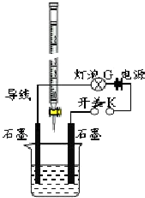 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.(1)实验时,烧杯中应盛A(选A或B)溶液.
(2)若A为一元强酸,B为一元强碱,且a+b=13.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为5,原因是反应后烧杯中自由离子的浓度约为原溶液的一半.烧杯中得到的溶液pH=6.5.
(3)若A为强酸,B为强碱,且a+b=13.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是A为多元强酸.
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为M++H2O?MOH+H+.此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是④⑤(填序号).
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
分析 (1)根据根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液;
(2)根据该温度下的水的离子积判断两溶液反应后溶液酸碱性及溶液中离子浓度大小,从而判断溶液导电性大小;根据水的离子积计算出中性溶液中氢离子浓度,再计算出溶液的pH;
(3)根据电荷守恒判断溶液中阳离子浓度大于阴离子浓度原因;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱;从盐类的水解以及电荷守恒角度分析,注意两者等体积混合后溶液显碱性的信息.
解答 解:(1)根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液,故答案为:A;
(2)该温度下,水的离子积Kw=l×10-13,a+b=13的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的$\frac{1}{2}$,所以溶液的导电性为5;根据水的离子积可知,该温度下,中性溶液中氢离子浓度为:l×10-6.5mol/L,溶液的pH=6.5,
故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;6.5;
(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,
故答案为:A为多元强酸;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+;
易判断⑤是正确的电荷守恒关系式,由于溶液呈碱性,故c(OH-)>c(H+),排除①、③,
根据c(OH-)>c(H+)和c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),
由于OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),即④正确.若HR是强酸,此时溶液中不再有HR分子,此时②即是错误的,由于混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),这与题意“溶液呈碱性”不符,故⑥是错误的,
故答案为:M++H2O?MOH+H+;④⑤.
点评 本题考查了影响溶液导电性因素、强弱电解质的判断,题目难度较大,注意掌握影响溶液导电性因素,易错点为(4),注意溶液离子浓度大小比较的方法,尤其注意解答该题须知:①25℃时,pH之和为14的酸、碱溶液等体积混合,谁弱显谁性,无弱显中性(原因是:二者反应后,弱者有大量剩余,所以弱者电离显性).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 反应Na→Na2O→Na2O2中钠元素被连续氧化 | |
| B. | 1mol金属钠发生反应Na→Na2O和发生反应Na→Na2O2转移电子数相等 | |
| C. | 1molCl2与足量Fe反应转移3mol电子 | |
| D. | 将1molCl2通入1L水中转移的电子为1mol |
| 实验编号 | 合金质量(mg) | NO体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| A. | 硝酸的浓度为4.0mol•L-1 | B. | 硝酸的浓度为1.0mol•L-1 | ||
| C. | 至少需要NaOH溶液的体积为75mL | D. | 至少需要NaOH溶液的体积为85mL |
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)A的相对分子质量为90. |
| (2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)写出A中含有的官能团的名称 羧基、羟基. |
| (4)若A中含有4种不同环境的氢原子. | 综上所述,A的结构简式为 或HOCH2CH2COOH. 或HOCH2CH2COOH. |
| A. | 浓H2SO4 | B. | 碱石灰 | C. | 无水氯化钙 | D. | P2O5 |
| A. | 蛋白质 | B. | 食盐 | C. | 葡萄糖 | D. | 食醋 |
| A. | 反应中Al2(SO4)3被氧化 | |
| B. | Al2O3是氧化产物 | |
| C. | 该反应中,每转移0.3 mol电子生成5.04 L SO2 | |
| D. | 氧化产物与还原产物的质量之比为1:2 |

 .
.