题目内容
15.工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑,下列有关说法中正确的是( )| A. | 反应中Al2(SO4)3被氧化 | |
| B. | Al2O3是氧化产物 | |
| C. | 该反应中,每转移0.3 mol电子生成5.04 L SO2 | |
| D. | 氧化产物与还原产物的质量之比为1:2 |
分析 2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2↑中,S元素的化合价由0升高为+4价,S元素的化合价由+6价降低为+4价,以此来解答.
解答 解:A.S元素的化合价由+6价降低为+4价,则反应中Al2(SO4)3被还原,故A错误;
B.Al、O元素的化合价不变,则氧化铝不是氧化产物,故B错误;
C.状况未知,不能计算二氧化硫的体积,故C错误;
D.氧化产物、还原产物均为SO2,结合S原子守恒、电子守恒可知,氧化产物与还原产物的质量之比为1:2,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.如图所示的有机物可发生的反应类型有①取代 ②加成 ③消去 ④氧化( )

| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
10.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
20. 在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
 在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)=I-(aq)?I${\;}_{3}^{-}$(aq)△H>0 c(I3-)/mol•L-1 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1 | |
| C. | 若T1时,反应进行到状态d时,一定有υ正>υ逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更高 |
7.已知:①2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
| A. | 由①式可知H2的燃烧热为241.8kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(1)△H>-483.6kJ/mol | |
| C. | 将含1mol NaOH的稀溶液与0.05mol浓硫酸溶液混合后放出的热量为57.3kJ | |
| D. | 将含1molBa(OH)2的稀溶液与含2mol HCl的稀溶液混合后放出的热量等于114.6kJ |
4.解释下列现象的化学用语不正确的是( )
| A. | CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 向CU(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀黑色:Cu(OH)2(s)+S2-?CuS(s)+2OH- | |
| C. | 新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ |
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于 1.0 (填“大于”“等于”或“小于”)
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃下,若物质的浓度关系是c (CO2)•c (H2)>c (CO)•c (H2O),则此时正反应速率与逆反应速率的关系是a.
a.v正>v逆 b.v正=v逆 c.v正<v逆 d.无法判断
(5)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于 1.0 (填“大于”“等于”或“小于”)
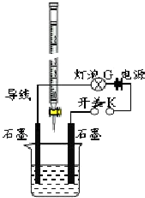 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.