题目内容
下列说法正确的是( )
| A、冰融化时,分子中H-O键发生断裂 |
| B、随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高 |
| C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 |
| D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定 |
考点:化学键,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.冰融化时只破坏范德华力;
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比;
C.物质的熔沸点与化学键无关;
D.物质的稳定性与化学键有关.
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比;
C.物质的熔沸点与化学键无关;
D.物质的稳定性与化学键有关.
解答:
解:A.冰融化时发生物理变化,只破坏范德华力而不破坏化学键,故A错误;
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比,所以随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高,故B正确;
C.物质的熔沸点与化学键无关,水的熔沸点比H2S高因为水中存在氢键,故C错误;
D.物质的稳定性与化学键有关,与范德华力无关,故D错误;
故选B.
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比,所以随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高,故B正确;
C.物质的熔沸点与化学键无关,水的熔沸点比H2S高因为水中存在氢键,故C错误;
D.物质的稳定性与化学键有关,与范德华力无关,故D错误;
故选B.
点评:本题考查了物质的性质,知道物质的哪些性质取决于范德华力、哪些性质取决于化学键是解本题关键,知道氢键对物质性质的影响,注意氢键不属于化学键,为易错点.

练习册系列答案
相关题目
下列关于苯酚的叙述不正确的是( )
| A、苯酚是一种弱酸,滴加指示剂变色 |
B、苯酚在水溶液中能按下式电离: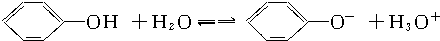 |
| C、苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性 |
| D、苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |
卤族元素有F、Cl、Br、I、At等元素,下列关于At的推断不正确的是( )
| A、At2的颜色比I2深 |
| B、HAt的水溶液的酸性比盐酸强 |
| C、AgAt不溶于水 |
| D、HAt很稳定,受热不易分解 |
下列各组中两个变化所发生的反应,属于同一类型的是( )
①由苯制环己烷;由乙烯制溴乙烷
②乙烯使溴水褪色;乙炔使酸性高锰酸钾水溶液褪色
③由乙烯制聚乙烯;由2-溴丙烷制丙烯
④由苯制硝基苯;由苯制溴苯.
①由苯制环己烷;由乙烯制溴乙烷
②乙烯使溴水褪色;乙炔使酸性高锰酸钾水溶液褪色
③由乙烯制聚乙烯;由2-溴丙烷制丙烯
④由苯制硝基苯;由苯制溴苯.
| A、只有②③ | B、只有③④ |
| C、只有①③ | D、只有①④ |
下列事实不能用于判断元素非金属性强弱的是( )
| A、非金属单质间发生的置换反应 |
| B、1mol非金属单质在反应中得到电子的多少 |
| C、非金属元素的最高价氧化物对应水化物的酸性强弱 |
| D、非金属元素的单质与氢气反应的难易 |
某电子层当它作为最外层时,最多只能容纳8个电子,当它作为内层时,最多只能容纳18个电子,该电子层可能是( )
| A、M层 | B、K层 | C、L层 | D、N层 |
下列热化学方程式正确的是( )
| A、甲烷的标准燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | ||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ?mol-1 | ||
C、已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+
| ||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为 H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 |
 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A、B、C两点的平衡常数:B=C |
| B、A、C两点气体的颜色:A深,C浅 |
| C、A、C两点气体的平均相对分子质量:A>C |
| D、由状态A到状态B,可以用降温的方法 |