题目内容
下列热化学方程式正确的是(注:△H的绝对值均正确)( )
| A、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
| B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) |
| C、S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) |
| D、2CH3OH(l)+3 O2(g)=2CO2(g)+4H2O(l)△H=-1452 kJ?mol-1(燃烧热) |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:可燃物完全燃烧生成稳定氧化物,如H→液态水,C→CO2.根据燃烧热的定义要点来判断;
B、在稀溶液中,强酸跟强碱发生生成1 mol水时的反应热 叫做中和 热.定义要点:以生成1 mol水为基准,根据中和热的定义要点来判断;
C、根据反应热的定义来判断;
D、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:规定可燃物物质的量为1 mol,根据燃烧热的定义要点来判断;
B、在稀溶液中,强酸跟强碱发生生成1 mol水时的反应热 叫做中和 热.定义要点:以生成1 mol水为基准,根据中和热的定义要点来判断;
C、根据反应热的定义来判断;
D、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:规定可燃物物质的量为1 mol,根据燃烧热的定义要点来判断;
解答:
解:A、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:可燃物完全燃烧生成稳定氧化物,如H→液态水,C→CO2.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)生成的是水蒸气,故△H=-1367.0 kJ/mol不是燃烧热,故A错误;
B、在稀溶液中,强酸跟强碱发生生成1 mol水时的反应热 叫做中和 热.定义要点:1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)═H2O(l)中和热均为57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ?mol-1; 3.以生成1 mol水为基准,故NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)中△H=-57.3kJ/mol为中和热,B正确;
C、等温下化学反应反应释放或吸收的热量称为反应热,故S(s)+O2(g)═SO2(g)中△H=-269.8kJ/mol是反应热,故C正确;
D、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:规定可燃物物质的量为1 mol,而反应
2CH3OH(l)+3 O2(g)=2CO2(g)+4H2O(l)中的△H=-1452 kJ?mol-1是2mol甲醇燃烧的反应热,故不是燃烧热,D错误.
故选BC.
B、在稀溶液中,强酸跟强碱发生生成1 mol水时的反应热 叫做中和 热.定义要点:1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)═H2O(l)中和热均为57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ?mol-1; 3.以生成1 mol水为基准,故NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)中△H=-57.3kJ/mol为中和热,B正确;
C、等温下化学反应反应释放或吸收的热量称为反应热,故S(s)+O2(g)═SO2(g)中△H=-269.8kJ/mol是反应热,故C正确;
D、在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:规定可燃物物质的量为1 mol,而反应
2CH3OH(l)+3 O2(g)=2CO2(g)+4H2O(l)中的△H=-1452 kJ?mol-1是2mol甲醇燃烧的反应热,故不是燃烧热,D错误.
故选BC.
点评:本题考查了燃烧热和中和热以及反应热的概念,把握住定义要点是关键,难度适中.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论肯定正确的是( )


| A、该分子含有一个肽键,属于二肽 |
| B、该物质能发生水解反应 |
| C、该物质不能与溴水反应 |
| D、其官能团和营养成分与葡萄糖相同 |
雾霾是雾和霾的混合物,在空气中能形成溶胶,PM2.5是“罪魁”.下列有关说法中不正确的是( )
| A、化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘都是形成雾霾天气的原因之一 |
| B、调整工业能源结构,研制开发燃料电池汽车,能有效地减少PM2.5的污染 |
| C、PM2.5粒径小,富含大量的有毒、有害物质,佩戴口罩就能防止PM2.5的污染,因此不必治理 |
| D、在雾霾天气中,开车打开车灯时从侧面可能看到一条光亮的通路 |
下列叙述的方法不正确的是( )
| A、金属的电化学腐蚀比化学腐蚀更普遍 |
| B、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-═4OH- |
| C、钢铁在干燥空气中不易被腐蚀 |
| D、用牺牲锌块的方法来保护船身 |
下列离子方程式书写正确的是( )
| A、钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、氯气通入水:Cl2+H2O═2H++Cl-+ClO- |
| C、碳酸钙加入到酸酸溶液中:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
| D、向澄清石灰水中加入少量的碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
某有机物的结构为: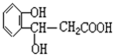 ,能发生的反应类型有( )
,能发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚.
 ,能发生的反应类型有( )
,能发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚.
| A、①③⑥ | B、①②⑤⑥ |
| C、②③④⑦ | D、除⑤外 |
在实验室做下列实验时,不适宜的是( )
| A、用量筒量取12.36ml盐酸 |
| B、用托盘天平称取2.7g食盐 |
| C、把浓硫酸沿杯壁注入水中并用玻璃棒搅拌,冷却至室温 |
| D、量筒没有零刻度线 |
