题目内容
8.短周期主族元素X、Y、Z、W、R的原子序数依次增大,其中前四种元素原子的最外层电子数之和为14.X是周期表中原子半径最小的元素,Z是短周期中金属性最强的元素,Y与W同主族.下列说法不正确的是( )| A. | 原子半径:X<W<Z | |
| B. | 最高价氧化物对应水化物的酸性:W>R | |
| C. | R在周期表中的位置为第三周期ⅦA族 | |
| D. | 简单气态氢化物的热稳定性:Y>W |
分析 短周期主族元素X、Y、Z、W、R的原子序数依次增大,X是周期表中原子半径最小的元素,应为H元素;Z是短周期中金属性最强的元素,为Na元素;X、Y、Z、W四种元素原子的最外层电子数之和为14,则Y与W原子最外层电子数之和=14-1-1=12,Y与W同主族,则Y、W的最外层电子数为6,Y为O、W为S元素;R的原子序数大于S,只能为Cl元素,据此结合元素周期律知识解答.
解答 解:短周期主族元素X、Y、Z、W、R的原子序数依次增大,X是周期表中原子半径最小的元素,应为H元素;Z是短周期中金属性最强的元素,为Na元素;X、Y、Z、W四种元素原子的最外层电子数之和为14,则Y与W原子最外层电子数之和=14-1-1=12,Y与W同主族,则Y、W的最外层电子数为6,Y为O、W为S元素;R的原子序数大于S,只能为Cl元素,
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径的大小顺序:X<W<Z,故A正确;
B.Y为O元素,W为S,非金属性越强,最高价氧化物对应的水化物的酸性越强,但是O无最高正价,也无对应的酸,故B错误;
C.R为Cl元素,原子序数为17,位于周期表中第三周期ⅦA族,故C正确;
D.元素的非金属性越强,其简单氢化物的稳定性越强,非金属性Y>W,则气态氢化物稳定性:Y>W,故D正确;
故选B.
点评 本题考查原子结构和元素周期律的关系,为高频考点,涉及元素周期律应用等知识点,正确判断元素是解本题关键,知道非金属性、金属性强弱判断方法,题目难度不大.

练习册系列答案
相关题目
6.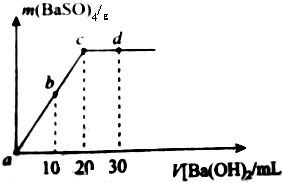 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )| A. | Ba(OH)2的物质的量浓密度为0.35mol/L | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.175mol/L | |
| C. | c时刻溶液显中性 | |
| D. | 实验过程中a、b、c三处溶液的导电能力c<b<a |
19.有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:7030Zn+20882Pb═277112Cn+10n
下列叙述中正确的是( )
下列叙述中正确的是( )
| A. | Cn元素的相对原子质量为277 | |
| B. | 277112Cn的原子核内中子数比质子数多53 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
16.下列有关化学用语使用正确的是( )
| A. | 乙酸、葡萄糖、淀粉的最简式均为CH2O | |
| B. | 羟基的电子式为 | |
| C. | 乙醇分子的球棍模型为  | |
| D. | 2-羟基丁酸的键线式为 |
3.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )
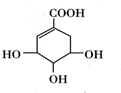

| A. | 分子式为C7H10O5 | |
| B. | 1mol该有机物与足量的钠发生反应,最多消耗3molNa | |
| C. | 该有机物既可与乙醇发生酯化反应,也可与乙酸发生酯化反应 | |
| D. | 该有机物可使KMnO4溶液褪色 |
13.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( )


| A. | 能发生氧化、取代、加成反应 | |
| B. | 分子中含有2个手性碳原子 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗5 mol NaOH |
20.如图,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )


| A. | 锌片是原电池负极 | B. | 铜片质量逐渐减少 | ||
| C. | H+在负极得到电子被还原 | D. | 电流从锌片经导线流向铜片 |
18.CuS 与HNO3反应后的产物为CuSO4、NO和H2O,下列说法正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为 8﹕3 | |
| B. | 氧化剂与还原剂的物质的量之比为 3﹕8 | |
| C. | 若有 1 mol NO 气体生成,转移的电子总数为 6 mol | |
| D. | 反应的离子方程式为 CuS+2H++2NO3-═Cu2++2NO↑+SO42-+H2O |