题目内容
(1)下列问题与盐的水解有关的是
①NH4Cl和ZnCl2溶液可作焊接金属中的除锈剂
②加热FeCl3溶液颜色逐渐加深
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
A.仅①②③B.仅①②③④C.仅①③④D.①②③④
(2)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(3)氯化铝水溶液呈 性,原因是(用离子方程式表示): .
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(4)在粗制CuSO4?5H2O晶体中常含有杂质Fe2+.在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是
A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B.NH3?H2O C.CuO D.Cu(OH)2.
①NH4Cl和ZnCl2溶液可作焊接金属中的除锈剂
②加热FeCl3溶液颜色逐渐加深
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
A.仅①②③B.仅①②③④C.仅①③④D.①②③④
(2)FeCl3的水溶液呈
(3)氯化铝水溶液呈
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(4)在粗制CuSO4?5H2O晶体中常含有杂质Fe2+.在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是
A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B.NH3?H2O C.CuO D.Cu(OH)2.
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)NH4Cl、ZnCl2、FeCl3、NaHCO3、Na2CO3、Al2(SO4)3都是含有弱根离子的盐,对应的水溶液都能水解;
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中;
(3)AlCl3为强酸弱碱盐,Al3+水解溶液呈酸性,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
(4)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀.
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中;
(3)AlCl3为强酸弱碱盐,Al3+水解溶液呈酸性,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
(4)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀.
解答:
解:(1)①NH4Cl和ZnCl2溶液由于铵根离子、锌离子的水解会导致溶液显示酸性,可作焊接金属中的除锈剂,与盐的水解有关,故正确;
②FeCl3溶液中铁离子水解生成氢氧化铁,加热会促进水解,颜色逐渐加深,与盐的水解有关,故正确;
③NaHCO3与Al2(SO4)3两种溶液中的氯离子和碳酸氢根离子之间会双水解,产生二氧化碳,可作泡沫灭火剂,与盐的水解有关,故正确;
④Na2CO3溶液中碳酸根离子水解显示碱性,可以和玻璃的主要成分二氧化硅之间反应,所以实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞,与盐的水解有关,故正确;故答案为:①②③④;
(2))FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+2H+;抑制;
(3)AlCl3为强酸弱碱盐,Al3+水解:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,实验室配制氯化铝溶液时,为了抑制水解,可以加入少量的盐酸,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;Al2O3.
(4)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故只有B符合;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可,A、B将铜离子转化为沉淀,不符合,
故答案为:B;CD.
②FeCl3溶液中铁离子水解生成氢氧化铁,加热会促进水解,颜色逐渐加深,与盐的水解有关,故正确;
③NaHCO3与Al2(SO4)3两种溶液中的氯离子和碳酸氢根离子之间会双水解,产生二氧化碳,可作泡沫灭火剂,与盐的水解有关,故正确;
④Na2CO3溶液中碳酸根离子水解显示碱性,可以和玻璃的主要成分二氧化硅之间反应,所以实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞,与盐的水解有关,故正确;故答案为:①②③④;
(2))FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+2H+;抑制;
(3)AlCl3为强酸弱碱盐,Al3+水解:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,实验室配制氯化铝溶液时,为了抑制水解,可以加入少量的盐酸,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;Al2O3.
(4)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故只有B符合;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可,A、B将铜离子转化为沉淀,不符合,
故答案为:B;CD.
点评:本题考查盐类水解的应用、溶液酸碱性判断、蒸干溶液产物判断、离子浓度大小比较、分离提纯方法的选择和应用等知识,理解盐类水解实质是关键,题目较简单.

练习册系列答案
相关题目
富含维生素A的食物为( )
| A、动物肝脏 | B、水果 |
| C、谷物 | D、面包 |
下列叙述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、铜锌原电池工作时,电流沿外电路从铜电极流向锌电极 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、为加快锌粒与盐酸反应的速率,可以向溶液中加入几滴氯化铜溶液 |
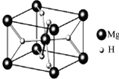 MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
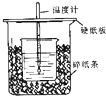 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

 反应①的类型是:
反应①的类型是: