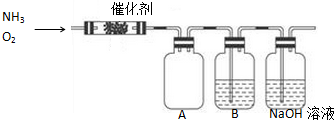
题目内容
11.下列说法不正确的是( )| A. | 乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油” | |
| B. | 甲基丙烯酸甲酯可以发生加成、水解和氧化反应 | |
| C. | 苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA | |
| D. | 乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
分析 A.汽油属于化石能源,不是可再生能源;
B.甲基丙烯酸甲酯含有碳碳双键,具有烯烃的性质,含有酯基,具有酯的性质;
C.苯甲酸分子式为C7H6O2,改写为C6H6.CO2,1mol苯与1mol苯甲酸耗氧量相等;
D.乙苯能被酸性KMnO4溶液氧化,而乙烷不能,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼.
解答 解:A.汽油属于化石能源,不是可再生能源,故A错误;
B.甲基丙烯酸甲酯含有碳碳双键,可以发生加成反应、氧化反应,含有酯基,可以发生水解反应,故B正确;
C.苯甲酸分子式为C7H6O2,改写为C6H6.CO2,1mol苯与1mol苯甲酸耗氧量相等,1mol混合物耗氧量为(6+$\frac{6}{4}$)mol=7.5mol,消耗O2的分子数为7.5NA,故C正确;
D.乙苯能被酸性KMnO4溶液氧化,而乙烷不能,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼,故D正确,
故选:A.
点评 本题考查有机物结构与性质、有机物燃烧计算、有机物结构中基团相互影响等,注意掌握官能团的性质与转化,C中注意利用改写法、燃烧通式进行解答,难度不大.

练习册系列答案
相关题目
1.下列说法中,不正确的是( )
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
19.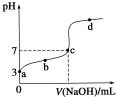 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
6.只用一种试剂可以区别MgCl2、FeCl2、AlCl3三种溶液,这种试剂是( )
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 硫酸 | D. | KNO3溶液 |
16.W、X、Y、Z是原子序数依次增大的同一短周期的主族元素.W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y.下列说法正确的是( )
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
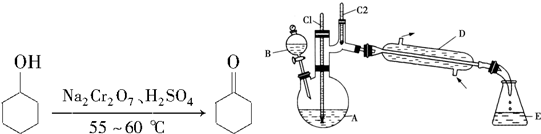
3.实验室合成环己酮的反应、装置示意图及有关数据如下:
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表
注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点.
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中通过装置B将酸性Na2Cr2O7溶液(查资料可知Cr是重金属元素,具有致癌性)加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①如何滴加酸性Na2Cr2O7溶液打开分液漏斗上边的玻璃塞,(或含有铬元素的物质)拧开下边的活塞,缓慢滴加,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有致癌危险的Na2Cr2O7(或避免使用含有致癌性铬元素的物质).
②蒸馏不能分离环己酮和水的原因是环己酮和水形成具有固定组成的恒沸物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 4 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.947 8 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 1 | |
| 水 | 100.0 | 0.998 2 |
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中通过装置B将酸性Na2Cr2O7溶液(查资料可知Cr是重金属元素,具有致癌性)加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①如何滴加酸性Na2Cr2O7溶液打开分液漏斗上边的玻璃塞,(或含有铬元素的物质)拧开下边的活塞,缓慢滴加,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有致癌危险的Na2Cr2O7(或避免使用含有致癌性铬元素的物质).
②蒸馏不能分离环己酮和水的原因是环己酮和水形成具有固定组成的恒沸物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
9. 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:
(1)则反应△H3=-90kJ•molˉ1;K2=0.5(填数据);
(2)850℃时,在密闭容器中进行反应①,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下
(Ⅰ)该时间段内反应速率v(H2)=0.12mol/(L•min);
(Ⅱ)比较此时正逆反应的速率的大小:v正>v逆(选填“>、<或=”);
(Ⅲ)反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向(选填“逆向”、“正向”或“不”)移动,该反应的平衡常数不变(选填“增大”“减小”“不变”).
(3)依据温度对反应①的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,甲醇物质的量变化的曲线示意图.
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
(2)850℃时,在密闭容器中进行反应①,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
(Ⅱ)比较此时正逆反应的速率的大小:v正>v逆(选填“>、<或=”);
(Ⅲ)反应达到平衡后,保持其他条件不变,只把容器的体积缩小一半,平衡正向(选填“逆向”、“正向”或“不”)移动,该反应的平衡常数不变(选填“增大”“减小”“不变”).
(3)依据温度对反应①的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,甲醇物质的量变化的曲线示意图.