题目内容
13.下列说法中正确的一组是( )| A. | H2和D2互为同素异形体 | B. | 正丁烷和异丁烷是同系物 | ||
| C. |  和 和 互为同分异构体 互为同分异构体 | D. |  和 和  是同一种物质 是同一种物质 |
分析 A.同种元素形成的不同单质互为同素异形体;
B.正丁烷和异丁烷的分子式相同,结构不同,互为同分异构体;
C. 和
和 是二溴甲烷在平面内的不同投影;
是二溴甲烷在平面内的不同投影;
D. 和
和  都是2-甲基丁烷.
都是2-甲基丁烷.
解答 解:A.H2、D2是由氢的同位素原子构成的氢分子,是同一种物质,故A错误;
B.正丁烷和异丁烷的分子式相同,结构不同,互为同分异构体,故B错误;
C. 和
和 是二溴甲烷在平面内的不同投影,是同一种物质,故C错误;
是二溴甲烷在平面内的不同投影,是同一种物质,故C错误;
D. 和
和  是同一种物质,2-甲基丁烷,故D正确;
是同一种物质,2-甲基丁烷,故D正确;
故选D.
点评 本题考查基本概念,涉及同系物、同分异构体、同素异形体、同种物质的辨析,难度不大,特别注意同分异构体和同种物质的辨别.

练习册系列答案
相关题目
4.关于下列图示的说法中错误的是( )


| A. | 用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集H2气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
1.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)( )

| A. | 杠杆为导体或绝缘体时,均为B端高A端低 | |
| B. | 杠杆为导体或绝缘体时,均为B端低A端高 | |
| C. | 当杠杆为导体时,B端低A端高;杠杆为绝缘体时,B端高A端低 | |
| D. | 当杠杆为导体时,B端高A端低;杠杆为绝缘体时,B端低A端高 |
8.XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为( )
| A. | Ca和Cl | B. | K和S | C. | Ca和F | D. | Mg和F |
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 室温下,21.0 g乙烯与丙烯的混合气体中含有的碳原子数为1.5 NA | |
| B. | 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA | |
| C. | 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA | |
| D. | 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA |
5.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出②中反应的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl
(3)现由6种粒子Mn2+、MnO${\;}_{4}^{-}$、H+、H2O、X2Y${\;}_{8}^{2-}$(C中含有的阴离子),XY${\;}_{4}^{2-}$完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO${\;}_{4}^{-}$需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}•H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为8.4g,E•xH2O的化学式为Na2C03•7H2O.
3.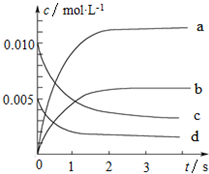 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
(1)从0~3s内,用NO表示的平均反应速率v(NO)=2.17×10-3mol•L-1•s-1.
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.