题目内容
14.氰化物有剧毒,工业废水中氰化物(CN-)的最高允许排放浓度为0.5mg/L;对废水中CN-(N为-3价)的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化.发生的反应为:2CN-+8OH-+5Cl2═2CO2↑+N2↑+10Cl-+4H2O.下列有关说法正确的是( )| A. | 上述反应中氧化产物只有N2 | |
| B. | 当有0.4molCO2生成时,反应中转移的电子的总数目约为1.204×1024 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.02mg/L的废水,至少需用4.0×10-5molCl2处理后才符合排放标准 |
分析 反应2CN-+8OH-+5Cl2=2CO2↑+N2↑+10Cl-+4H2O中,Cl元素的化合价由0降低为-1价,N元素的化合价由-3价升高为0,C元素的化合价由+2价升高为+4价,该反应中转移10e-,以此解答.
解答 解:A.C、N元素化合价都升高,则氧化产物有N2、CO2,故A错误;
B、由反应可知,生成2molCO2时,转移10mol电子,则有0.4 mol CO2生成时,反应中转移的电子的总数目约为$\frac{0.4}{2}$mol×10×NA=2×6.02×1023,故B正确;
C、由反应可知,生成2molCO2的同时,生成10molCl-,反应前后阴离子数目不变,则当有0.2mol CO2生成时,溶液中阴离子的物质的量不变,故C错误;
D.n(CN-)=$\frac{1.02×1{0}^{-3}g}{26g/mol}$≈4.0×10-5mol,由方程式可知需要1×10-4mol 氯气,故D错误.
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及氧化还原反应中规律性知识为解答的关键,选项D为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在某无色透明的酸性溶液中,能共存的离子组是( )
| A. | Na+、K+、$S{O_4}^{2-}$、$HC{O_3}^-$ | B. | Cu2+、K+、$S{O_4}^{2-}$、$N{O_3}^-$ | ||
| C. | Na+、K+、Cl-、$S{O_4}^{2-}$ | D. | Fe2+、K+、$N{O_3}^-$、$C{H_3}CO{O^-}$ |
9.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | ClO2是还原产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1molKClO3参加反应,转移电子物质的量为1mol | |
| D. | 生成5.6LCO2,转移的电子数目为0.25NA |
19.化学反应的离子方程式正确的是( )
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
3.下列状态的物质,既能导电又属于电解质的是( )
| A. | 盐酸 | B. | NH3 | C. | 熔融的K2O | D. | BaSO4晶体 |
4.下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
| 选项 | 离 子 | 要 求 |
| A | K+、NO3-、Cl-、SO42- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、CO32-、Cl- | 逐滴加入盐酸立即有气体产生 |
| C | Na+、Cu2+、Mg2+、SO42- | 逐滴加入NaOH溶液立即有沉淀产生 |
| D | H+、NH4+、Al3+、SO42- | 逐滴加入NaOH溶液立刻有气体产生 |
| A. | A | B. | B | C. | C | D. | D |

 .
.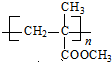 .
.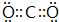 .
.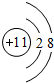 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式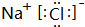 .
. (1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现
(1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现