题目内容
 有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:| 元素 | 元素的相关信息 |
| A | 存在多种核素,其中一种核素没有中子 |
| B | 核外电子排布式三个能级上的电子数相同 |
| C | 其第一电离能比同周期相邻元素的第一电离能都大 |
| D | 最外层电子数是内层电子数三倍的元素 |
| E | 单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F | 位于第三周期ⅦA族 |
| G | 未成对电子数最多的副族元素 |
(2)D、E、F三种元素的简单离子的离子半径由大到小的顺序是(用微粒符号表示)
(3)B、C、F三种元素的最高价氧化物的水化物的酸性最强的是
(4)由上述两种元素组成的与O3互为等电子体的负一价阴离子的化学式为
(5)由B、C、E三种元素的三原子组成的含σ键和π键的离子化合物的电子式
(6)由A、B、D三种元素组成的有两种官能团的能形成分子内氢键的芳香族化合物的结构简式为
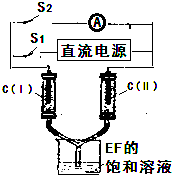
(7)如图所示装置,两玻璃管中盛满滴有酚酞溶液的EF饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:C(Ⅱ)的电极反应式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,A存在多种核素,其中一种核素没有中子,则A是H元素;
B核外电子排布式三个能级上的电子数相同,都是2个电子,则B是C元素;
D最外层电子数是内层电子数三倍的元素,最外层电子数不能超过8个,则C内层电子数是2,最外层电子数是6,为O元素;
C其第一电离能比同周期相邻元素的第一电离能都大,且在B和D元素之间,则C是N元素;
E单质或其化合物在火焰灼烧时,火焰呈黄色,则E是Na元素;
F位于第三周期ⅦA族,则F是Cl元素;
G未成对电子数最多的副族元素为位于前四周期,则G是Cr元素,
再结合题目分析解答.
B核外电子排布式三个能级上的电子数相同,都是2个电子,则B是C元素;
D最外层电子数是内层电子数三倍的元素,最外层电子数不能超过8个,则C内层电子数是2,最外层电子数是6,为O元素;
C其第一电离能比同周期相邻元素的第一电离能都大,且在B和D元素之间,则C是N元素;
E单质或其化合物在火焰灼烧时,火焰呈黄色,则E是Na元素;
F位于第三周期ⅦA族,则F是Cl元素;
G未成对电子数最多的副族元素为位于前四周期,则G是Cr元素,
再结合题目分析解答.
解答:
解:有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,A存在多种核素,其中一种核素没有中子,则A是H元素;
B核外电子排布式三个能级上的电子数相同,都是2个电子,则B是C元素;
D最外层电子数是内层电子数三倍的元素,最外层电子数不能超过8个,则C内层电子数是2,最外层电子数是6,为O元素;
C其第一电离能比同周期相邻元素的第一电离能都大,且在B和D元素之间,则C是N元素;
E单质或其化合物在火焰灼烧时,火焰呈黄色,则E是Na元素;
F位于第三周期ⅦA族,则F是Cl元素;
G未成对电子数最多的副族元素为位于前四周期,则G是Cr元素,
(1)G元素为Cr元素,Cr原子的价层电子就是其3d、4s电子,则Cr元素的价层电子排布式为3d54s1,故答案为:3d54s1;
(2)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小,所以D、E、F三种元素的简单离子的离子半径由大到小的顺序是(用微粒符号表示)Cl-、O2-、Na+,故答案为:Cl-、O2-、Na+;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,B、C、F三种元素非金属性最强的是Cl元素,B、C、F三种元素的最高价氧化物的水化物的酸性最强的是高氯酸,故答案为:高氯酸;
(4)原子个数相等、价电子数相等的微粒互为等电子体,由上述两种元素组成的与O3互为等电子体的负一价阴离子的化学式为NO2-,故答案为:NO2-;
(5)单键中只含σ键,双键和三键中含有σ键和π键,由B、C、E三种元素的三原子组成的含σ键和π键的离子化合物的电子式 ,
,
故答案为: ;
;
(6)由A、B、D三种元素组成的有两种官能团的能形成分子内氢键的芳香族化合物的结构简式为 ,故答案为:
,故答案为: ;
;
(7)如图所示装置,两玻璃管中盛满滴有酚酞溶液的EF饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成,则C(I)是阴极、C(II)是阳极,C(I)上生成氢气、C(II)上生成氯气,一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,构成原电池,C(II)上氯气得电子发生还原反应,此时:C(Ⅱ)的电极反应式是Cl2+2e-=2Cl-,故答案为:Cl2+2e-=2Cl-.
B核外电子排布式三个能级上的电子数相同,都是2个电子,则B是C元素;
D最外层电子数是内层电子数三倍的元素,最外层电子数不能超过8个,则C内层电子数是2,最外层电子数是6,为O元素;
C其第一电离能比同周期相邻元素的第一电离能都大,且在B和D元素之间,则C是N元素;
E单质或其化合物在火焰灼烧时,火焰呈黄色,则E是Na元素;
F位于第三周期ⅦA族,则F是Cl元素;
G未成对电子数最多的副族元素为位于前四周期,则G是Cr元素,
(1)G元素为Cr元素,Cr原子的价层电子就是其3d、4s电子,则Cr元素的价层电子排布式为3d54s1,故答案为:3d54s1;
(2)离子的电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小,所以D、E、F三种元素的简单离子的离子半径由大到小的顺序是(用微粒符号表示)Cl-、O2-、Na+,故答案为:Cl-、O2-、Na+;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,B、C、F三种元素非金属性最强的是Cl元素,B、C、F三种元素的最高价氧化物的水化物的酸性最强的是高氯酸,故答案为:高氯酸;
(4)原子个数相等、价电子数相等的微粒互为等电子体,由上述两种元素组成的与O3互为等电子体的负一价阴离子的化学式为NO2-,故答案为:NO2-;
(5)单键中只含σ键,双键和三键中含有σ键和π键,由B、C、E三种元素的三原子组成的含σ键和π键的离子化合物的电子式
 ,
,故答案为:
 ;
;(6)由A、B、D三种元素组成的有两种官能团的能形成分子内氢键的芳香族化合物的结构简式为
 ,故答案为:
,故答案为: ;
;(7)如图所示装置,两玻璃管中盛满滴有酚酞溶液的EF饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成,则C(I)是阴极、C(II)是阳极,C(I)上生成氢气、C(II)上生成氯气,一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,构成原电池,C(II)上氯气得电子发生还原反应,此时:C(Ⅱ)的电极反应式是Cl2+2e-=2Cl-,故答案为:Cl2+2e-=2Cl-.
点评:本题考查位置结构性质的相互关系及应用,涉及原电池和电解池原理、等电子体、氢键、离子半径半径等知识点,这些都是高考高频点,要熟练掌握,注意(7)中各个电极上发生的反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下述实验能达到预期目的是( )
| A、检验乙醛中的醛基:在一定量CuSO4溶液中,加入少量NaOH溶液,然后再加入乙醛,加热产生砖红色沉淀 |
| B、分离提纯苯:向苯和苯酚混合溶液中加入足量浓溴水,静置后分液 |
| C、比较CH3COO-和CO32-结合H+的能力:相同温度下,测定浓度均为0.1mol?L-1的Na2CO3和CH3COONa溶液的pH |
| D、检验蔗糖水解产物,向蔗糖溶液中加入稀硫酸溶液共热,冷却后滴入银氨溶液,观察有无银镜生成 |
BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF4-离子,则BF3和BF4-中的B原子的杂化轨道类型分别是( )
| A、sp2、sp2 |
| B、sp3、sp3 |
| C、sp2、sp3 |
| D、sp、sp2 |

 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题: A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答: 纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法: