题目内容
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
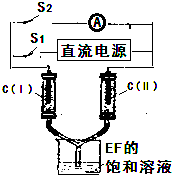
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:(1)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中
产生的气体全部逸出,测得溶液pH变化如图所示.则在0→t1
时间内,阳极反应式为
(2)含氨废水易引发水体富营养化.向NH4C1溶液中加入少量NaOH固体,溶液中
| [NH3?H2O] |
| [NH4+][OH-] |
的电离平衡常数Kb=1.8×10-5mo1?L-1,该温度下,1mo1?L-1的NH4C1溶液中c(H+)=
| 5.56 |
(3)如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式
(4)某工业生产中,向含有大量Ca2+、Mn2+的溶液中加入足量NH4HCO3,生成MnCO3沉淀和CO2,写出该反应的离子方程式
| c(Ca2+) |
| c(Mn2+) |
[已知Ksp(MnCO3)=1×10-11(mol?L-1)2,Ksp(CaCO3)=5×10-9(mol?L-1)2].
考点:电解原理,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯和除杂
专题:电离平衡与溶液的pH专题,电化学专题
分析:(1)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水;
(2)
为NH3?H2O电离平衡常数的倒数,温度不变,常数不变,NH4Cl溶液中存在NH4++H2O?NH3?H2O+H+,结合NH3?H2O电离平衡常数以及Kw计算;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;BaCO3与硫酸根离子反应生成BaSO4;
(4)依据原子守恒结合反应特征分子推断反应产物,根据沉淀溶解平衡常数的关系进行计算.
(2)
| [NH3?H2O] |
| [NH4+][OH-] |
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;BaCO3与硫酸根离子反应生成BaSO4;
(4)依据原子守恒结合反应特征分子推断反应产物,根据沉淀溶解平衡常数的关系进行计算.
解答:
解:(1)在0→t1时间内,相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑;
用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,故答案为:2Cl--2e-=Cl2↑;HCO3-+OH-=CO32-+H2O;
(2)
为NH3?H2O电离平衡常数的倒数,温度不变,常数不变,
已知①NH3?H2O?NH4++OH-,Kb=1.8×10-5mol?L-1,
②H2O?H++OH-,Kw=1.0×10-14,
则②-①可得NH4++H2O?NH3?H2O+H+,K=
=
×10-9,
则1mol?L-1的NH4Cl溶液中c(H+)=
=
mol/L=2.36×10-5mol?L-1,
故答案为:2.36×10-5;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用,BaCO3与硫酸根离子反应生成BaSO4,BaCO3(s)+SO42-(aq)=BaSO4(s)+CO3 2-(aq);
故答案为:ac;BaCO3(s)+SO42-(aq)=BaSO4(s)+CO3 2-(aq);
(4)锰离子和碳酸氢根离子之间可以发生双水解反应,即Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,Ksp(MnCO3)=c(Mn2+)?c(CO32-)=1×10-11(mol?L-1)2,Ksp(CaCO3)=c(Ca2+)?c(CO32-)=5×10-9(mol?L-1)2,两式子相除,得到:剩余溶液中
<500,故答案为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;500.
用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,故答案为:2Cl--2e-=Cl2↑;HCO3-+OH-=CO32-+H2O;
(2)
| [NH3?H2O] |
| [NH4+][OH-] |
已知①NH3?H2O?NH4++OH-,Kb=1.8×10-5mol?L-1,
②H2O?H++OH-,Kw=1.0×10-14,
则②-①可得NH4++H2O?NH3?H2O+H+,K=
| 1×10-14 |
| 1.8×10-5 |
| 1 |
| 1.8 |
则1mol?L-1的NH4Cl溶液中c(H+)=
| K×c(NH4+) |
|
故答案为:2.36×10-5;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用,BaCO3与硫酸根离子反应生成BaSO4,BaCO3(s)+SO42-(aq)=BaSO4(s)+CO3 2-(aq);
故答案为:ac;BaCO3(s)+SO42-(aq)=BaSO4(s)+CO3 2-(aq);
(4)锰离子和碳酸氢根离子之间可以发生双水解反应,即Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,Ksp(MnCO3)=c(Mn2+)?c(CO32-)=1×10-11(mol?L-1)2,Ksp(CaCO3)=c(Ca2+)?c(CO32-)=5×10-9(mol?L-1)2,两式子相除,得到:剩余溶液中
| c(Ca2+) |
| c(Mn2+) |
点评:本题考查较为综合,涉及电化学知识、弱电解质的电离以及沉淀溶解平衡,侧重于学生的分析能力和计算能力的考查,为高频考点,难度较大,注意相关计算公式的运用.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4质的量浓度为0.2mol/.向其中加入2.56克Cu粉,待充分反应后,溶液中的Cu2+的物质的量浓度是( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.225mol/L |
| D、无法计算 |
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
| A、CaO2具有氧化性,对面粉可能具有增白作用 |
| B、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2 |
| C、CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D、CaO2中阴阳离子的个数比为1:1 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、在pH=1的无色溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、含有大量Al3+的溶液:Na+、C1-、NO3-、OH- |
| D、含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
下列叙述中不正确的是( )
| A、向含有少量CaCO3沉淀的水中通入CO2,沉淀溶解;再向溶液中加入Na2CO3溶液,又有CaCO3沉淀生成 |
| B、向Na2CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,NaHCO3生成的CO2较多 |
| D、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
下列离子方程式错误的是( )
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、烧碱溶液中滴入少量同物质的量浓度的氯化铝溶液 Al3++4OH-═AlO2-+2H2O |
| C、向碳酸钠溶液中滴加少量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |
 有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表: