题目内容
1.1mol CH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO气体和液态H2O时,放出的热量为519kJ.如果1mol CH4与n g O2燃烧生成CO、CO2气体和液态H2O,放出731.25kJ热量.(1)写出CH4气体不完全燃烧的热化学方程式.
(2)计算n的值.
分析 题意可知不完全燃烧的热化学方程式为:2CH4 (g)+3O2 (g)═2CO(g)+4H2O(l)△H=-1038 kJ•mol-1或CH4 (g)+$\frac{3}{2}$O2 (g)═CO(g)+2H2O(l)△H=-519 kJ•mol-1①,
同理完全燃烧的热化学方程式为:CH4 (g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-802 kJ•mol-1②
可设不完全燃烧、完全燃烧的CH4的物质的量分别是x、y,由①②得
CH4-$\frac{3}{2}$O2-CO-519 kJ
x x•$\frac{3}{2}$ 519x kJ
CH4-2O2-CO2-802 kJ
Y 2y 802y kJ
得关系式x+y=1 mol
x•$\frac{3}{2}$+2y=$\frac{n}{32}$ mol
以此计算得到.
解答 解:1mol CH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO气体和液态H2O时,放出的热量为519kJ,由题意可知不完全燃烧的热化学方程式为:
2CH4 (g)+3O2 (g)═2CO(g)+4H2O(l)△H=-1038 kJ•mol-1或CH4 (g)+$\frac{3}{2}$O2 (g)═CO(g)+2H2O(l);△H=-519 kJ•mol-1①,
同理完全燃烧的热化学方程式为:CH4 (g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-802 kJ•mol-1②
可设不完全燃烧、完全燃烧的CH4的物质的量分别是x、y,由①②得
CH4-$\frac{3}{2}$O2-CO-519 kJ
x x•$\frac{3}{2}$ 519x kJ
CH4-2O2-CO2-802 kJ
Y 2y 802y kJ
得关系式x+y=1 mol
x•$\frac{3}{2}$+2y=$\frac{n}{32}$ mol
519x kJ+802y kJ=731.25 kJ
解得:x=0.25 mol y=0.75 mol n=60.
(1)答:CH4气体不完全燃烧的热化学方程式为:2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H=-1038 kJ•mol-1或CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-519 kJ•mol-1
(2)答:计算得到n=60.
点评 本题考查了热化学方程式书写和热化学方程式定量计算,主要是反应焓变的计算,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 化合物都是由不同元素组成的,不同元素组成的物质一定是化合物 | |
| B. | 金属镁排在金属活动性顺序表中氢元素的前面,所以镁与酸反应一定放出氢气 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 氧化还原反应有元素化合价变化,有元素化合价变化的反应一定是氧化还原反应 |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
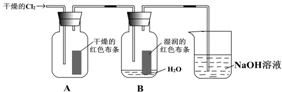 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验: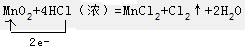
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.
 .
.