题目内容
17.l0ml浓度均为0.1mol/L的三种溶液:①HF溶液;②KOH溶液;③KF溶液.下列说法正确的是( )| A. | ①和②混合后,酸碱恰好中和,溶液呈中性 | |
| B. | ①和③中均有c(F-)+c(HF)=0.1mol/L | |
| C. | ①和③混合:c(F-)+c(OH-)=c(H+)+c(HF) | |
| D. | 由水电离出来的c(OH-):②>③>① |
分析 A.HF酸为弱酸,与KOH反应生成强碱弱酸盐;
B.根据物料守恒判断;
C.①和③混合,HF电离程度大于F-水解程度,结合电荷电荷守恒判断;
D.KF水解,促进水的电离.
解答 解:A.HF酸为弱酸,与KOH反应生成强碱弱酸盐,酸碱恰好中和,溶液呈碱性,故A错误;
B.浓度均为0.1mol/L的①和③,溶液中均存在HF、F-,由物料守恒可知c(F-)+c(HF)=0.1mol/L,故B正确;
C.①和③混合,由电荷守恒可知c(F-)+c(OH-)=c(H+)+c(K+),HF电离程度大于F-水解程度,则c(K+)>c(HF),所以c(F-)+c(OH-)>c(H+)+c(HF),故C错误;
D.KF水解,促进水的电离,由水电离出来的c(OH-):③>②>①,故D错误.
故选B.
点评 本题考查弱电解质的电离,为高考常见题型,题目难度中等,明确酸碱混合的判断,盐类水解的规律等知识即可解答,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
8.下列解释事实的方程式不正确的是( )
| A. | 焊接铁轨:2Fe+Al2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Al+Fe2O3 | |
| B. | 工业固氮:N2+3H2 $?_{催化剂}^{高温、高压}$ 2NH3 | |
| C. | 用纯碱除油污:CO32-+H2O?HCO3-+OH- | |
| D. | 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-═2Cl-+I2 |
5.下列说法中正确的是( )
| A. | 氨气溶于水能导电,故氨气属于电解质 | |
| B. | 碳酸钡难溶于水,故碳酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
12.短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为18,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M) | |
| B. | Z的气态氢化物比W的气态氢化物更稳定 | |
| C. | 分子式为Y5X12的物质只有3种 | |
| D. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 |
2.下列化学用语书写正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 丙烯的键线式: | ||
| C. | 苯的最简式为:CH | D. | 乙醇的结构式: |
8.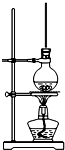 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
(1)写出该反应的化学方程式C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
