题目内容
7.在一定温度下,工业上合成尿素(H2NCONH2)的反应如下:2NH3(I)+CO2(g)?H2O(I)+H2NCONH2(I)△H=-103.7kJ•mol-1试回答下列问题:
(1)写出一种有利于提高尿素的产率的措施是加压或降温.
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(I)+CO2(g)?H2NCOONH4(I)(氨基甲酸铵)△H1
第二步:H2NCOONH4(I)?H2O(I)+H2NCONH2(I)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.2L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图甲所示:

①●●代表的物质为CO2(填化学式)
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,反应进行到10min时到达平衡.反应进行到10min时测得●●所代表的物质的量如图所示,则该物质表示的表示化学反应的速率为0.41mol•L-1•min.L-1
③第二步反应的平衡常数K2随温度的变化如乙图所示,则△H1 <0 (填“>”“<”或“=”).
④第一步反应在较低 (填“较高”或“较低”)温度下有利该反应自发进行.
(3)已知:
N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2 kJ•mol-1.
分析 (1)2NH3(l)+CO2(g)?H2O(l)+H2NCONH2(l)△H=-103.7kJ•mol-1 ,反应是放热反应,反应前后气体体积减小;有利于提高尿素的生成速率需要依据影响化学反应速率的因素进行分析;
(2)①根据反应方程式,各反应物、生成物的特点可知●●代表的物质为二氧化碳;
②已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;在一体积为0.2L的密闭容器中投入4mol氨和1mol二氧化碳,分析图象计算10分钟时二氧化碳的消耗物质的量,结合化学反应速率概念进行计算;
③由图Ⅱ可知,随着温度的升高,平衡常数增大,平衡向正反应方向移动;
④根据第一步的方程式可知,反应物中有气体,生成物中没气体,所以△S<0,根据△G=△H-T△S判断;
(3)根据已知方程式构建目标方程式,根据盖斯定律计算△H.
解答 解:(1)2NH3(l)+CO2(g)?H2O(l)+H2NCONH2(l)△H=-103.7kJ•mol-1 ,反应有气体参加,反应前后气体体积减小,采用增大压强,反应正向进行,尿素的产率增大,反应是放热反应,降温反应正向进行,尿素的产率增大,
故答案为:加压或降温;
(2)①合成尿素的反应,第一步:2NH3(I)+CO2(g)?H2NCOONH4,
第二步:H2NCOONH4(I)?H2O(I)+H2NCONH2,
投入4mol氨,且氨气在反应中始终减少,为 ,H2NCOONH4先增加,后减少,为
,H2NCOONH4先增加,后减少,为 ,物质的量始终在增加,
,物质的量始终在增加, 为尿素,
为尿素,
故答案为:CO2;
②由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第二步反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,投入1mol二氧化碳,减少趋势不大的●●代表的为二氧化碳,依据图象分析,二氧化碳再进行到10min时物质的量为0.18mol,所以此时的反应速率为V(CO2)=$\frac{\frac{n}{v}}{△t}$=$\frac{\frac{1mol-0.18mol}{0.2L}}{10min}$=0.41mol/(L•min),
故答案为:2; 0.41;
③由图Ⅱ可知,随着温度的升高,平衡常数增大,平衡向正反应方向移动,则正反应为吸热反应,△H2>0,2NH3(I)+CO2(g)?H2O(I)+H2NCONH2(I)△H=-103.7kJ•mol-1,则△H1,<0,
故答案为:<;
④根据第一步的方程式可知,反应物中有气体,生成物中没气体,所以△S<0,△H1,<0,根据△G=△H-T△S可知,温度较低时,△G可能小于0,即反应可以自发,
故答案为:较低;
(3)已知:①N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol-1
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
则(③×3-①×2-②×2)得:4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)根据盖斯定律,反应热的大小与反应的途径无关,只与反应的始态和终态有关,则△H=(-483.6kJ•mol-1)×3-(+180.6kJ•mol-1)×2-(-92.4kJ•mol-1)×2=-1627.2 kJ•mol-1,
故答案为:-1627.2 kJ•mol-1.
点评 本题考查了化学平衡、反应热的相关计算、化学平衡的移动原理等知识,侧重于考查学生对基础知识的综合应用能力,分析题干、图象分析反应的进行程度是解题关键,题目难度中等.

| A. | 澄清石灰水 | B. | 品红溶液 | ||
| C. | 湿润的蓝色石蕊试纸 | D. | 硝酸银溶液 |
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SiO3>H2SO4 | D. | 氧化性:Cl2>S |
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性KMnO4溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(甲苯) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液具有酸性 |
| A. | 键长:HF>HCl | B. | 键能:HF>HCl | ||
| C. | 稳定性:HCl>HF | D. | 共用电子对偏移程度:HCl>HF |
| A. | ①和②混合后,酸碱恰好中和,溶液呈中性 | |
| B. | ①和③中均有c(F-)+c(HF)=0.1mol/L | |
| C. | ①和③混合:c(F-)+c(OH-)=c(H+)+c(HF) | |
| D. | 由水电离出来的c(OH-):②>③>① |
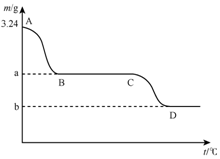 取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:
取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题: 已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等.
已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等.