题目内容
铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH) 2下列有关该电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
考点:化学电源新型电池
专题:
分析:根据电池反应式知,放电时,Fe和Ni2O3都生成氢氧化物,说明溶液呈碱性,Fe失电子作负极、正极为Ni2O3,负极反应式为Fe+2OH--2e-═Fe(OH)2,正极反应式为Ni2O3+3H2O+2e-═2Ni(OH)2+2OH-,充电时,阴阳极与负极、正极反应式正好相反,据此分析解答.
解答:
解:A.放电时,Fe失电子作负极、正极为Ni2O3,Fe和Ni2O3都生成氢氧化物,说明溶液呈碱性,故A正确;
B.放电时,Fe失电子和氢氧根离子反应生成氢氧化亚铁,电极反应式为Fe+2OH--2e-═Fe(OH)2,故B正确;
C.充电过程中,阴极反应式为Fe(OH)2+2e-═Fe+2OH-,有氢氧根离子生成,所以溶液的pH增大,故C错误;
D.充电时,阳极上失电子发生氧化反应,电极反应式为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O,故D正确;
故选C.
B.放电时,Fe失电子和氢氧根离子反应生成氢氧化亚铁,电极反应式为Fe+2OH--2e-═Fe(OH)2,故B正确;
C.充电过程中,阴极反应式为Fe(OH)2+2e-═Fe+2OH-,有氢氧根离子生成,所以溶液的pH增大,故C错误;
D.充电时,阳极上失电子发生氧化反应,电极反应式为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O,故D正确;
故选C.
点评:本题考查化学电源新型电池,明确各个电极上发生的电极反应是解本题关键,会根据元素化合价变化确定正负极及阴阳极,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如下:

(已知Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20).下列说法不正确的是( )

(已知Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20).下列说法不正确的是( )
| A、上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),如配制100 mL这种H2SO4溶液,则需要18.4 mol?L-1的浓硫酸约为49.9mL |
| B、加入氧化剂H2O2后,只有Fe(OH)3沉淀出现,若溶液中c(Fe3+)=2.6×10-15mol?L-1,则溶液中c(Cu2+)≤2.2×10-4mol?L-1 |
| C、若加入NH4HCO3后生成的沉淀是Zn5(OH)6(CO3)2,则该反应为5ZnSO4+10NH4HCO3=Zn5(OH)6(CO3)2↓+5(NH4)2SO4+8CO2↑+2H2O |
| D、若生成的沉淀是形态均为Zna(OH)b (CO3)c的(a、b、c都是正整数)两种碱式碳酸锌的混合物,则分别可能是Zn5(OH)6(CO3)2 与Zn3(OH)6CO3 |
下列叙述正确的是( )
| A、光导纤维、玻璃纤维、硝化纤维都是高分子化合物 |
| B、铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 |
| C、凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
| D、“地沟油”危害健康,不仅是因为人体所必需的维生素E、脂肪酸油脂已经被破坏,营养低,而且含有黄曲霉素、苯并芘,这两种毒素都是致癌物质 |
下列说法中正确的是( )
| A、适当摄入油脂,有助于人体吸收多种脂溶性维生素 |
| B、人体缺乏维生素D易引起夜盲症 |
| C、相对于各成分金属来说,合金的熔点更高,硬度更大 |
| D、柠檬酸在体内可以彻底氧化生成二氧化碳和水,所以柠檬是酸性食物 |
设NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
| A、标准状况下,4.48L水中含有的分子数目为0.2NA |
| B、0.1mol钠与足量水反应转移的电子数目为0.1NA |
| C、0.2mol?L-1CuSO4溶液中含有的SO42-离子数目为0.2NA |
| D、0.5molKClO3中含有Cl-的数目为0.5NA |
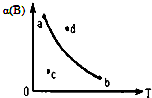 条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( )
条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( ) 氯是一种非常重要的非金属元素.
氯是一种非常重要的非金属元素.