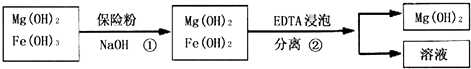
题目内容
已知HClO的结构式为H-O-Cl,下列有关说法正确的是( )
| A、氧原子发生SP杂化 |
| B、该分子为V型分子 |
| C、氧原子与H、Cl都形成π键 |
| D、该原子的电子式为H:O:Cl |
考点:判断简单分子或离子的构型
专题:原子组成与结构专题,化学键与晶体结构
分析:A、通过价层电子对互斥理论计算中心原子的价层电子对数,判断杂化类型;
B、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
C、共价单键为σ键;
D.次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构;
B、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
C、共价单键为σ键;
D.次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构;
解答:
解:A、HClO中O原子形成2个σ键,孤电子对个数=
×(6-2×1)=2,价层电子对数为4,为sp3杂化,故A错误;
B、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故B正确;
C、从次氯酸的结构式可以看出含有O-H、O-Cl,共价单键为σ键,故C错误;
D、H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为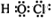 ,故D错误;
,故D错误;
故选B.
| 1 |
| 2 |
B、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故B正确;
C、从次氯酸的结构式可以看出含有O-H、O-Cl,共价单键为σ键,故C错误;
D、H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为
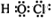 ,故D错误;
,故D错误;故选B.
点评:本题考查了次氯酸分子的结构,明确中心原子杂化类型的判断是解答本题的关键,题目难度中等.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列说法中正确的是( )
| A、适当摄入油脂,有助于人体吸收多种脂溶性维生素 |
| B、人体缺乏维生素D易引起夜盲症 |
| C、相对于各成分金属来说,合金的熔点更高,硬度更大 |
| D、柠檬酸在体内可以彻底氧化生成二氧化碳和水,所以柠檬是酸性食物 |
下列热化学方程式中,正确的是( )
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ?mol-1 |
设NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
| A、标准状况下,4.48L水中含有的分子数目为0.2NA |
| B、0.1mol钠与足量水反应转移的电子数目为0.1NA |
| C、0.2mol?L-1CuSO4溶液中含有的SO42-离子数目为0.2NA |
| D、0.5molKClO3中含有Cl-的数目为0.5NA |
下列分子是极性分子的是( )
| A、PCl3 |
| B、SO3 |
| C、BF3 |
| D、CS2 |
下列叙述正确的是( )
| A、离子化合物中只存在阴、阳离子之间的静电作用 |
| B、相同质量的N2、N4、N30含有的分子数相同 |
| C、23g钠和足量水反应失去6.02×1023个电子 |
| D、当1molCl2的体积为22.4L时,该氯气一定处于标准状况下 |
P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是( )
| A、NH3 |
| B、HI |
| C、H2S |
| D、SO2 |