题目内容
12.有A、B、C、D、E、F六种气体,分别是Cl2、O2、H2、CO2、HCl、HBr.其中A 和D 混合见光会发生爆炸;C和D混合时,点燃也会发生爆炸;若将F通入澄清石灰水,会产生浑浊,再通入B或E,浑浊又变澄清,将A和B混合时,有红棕色的液体在容器内壁生成,试写出(1)六种气体的化学式
ACl2 BHBr CO2 DH2 EHC FCO2
(2)写出 A 和D反应的化学方程式H2+Cl2$\frac{\underline{\;光\;}}{\;}$2HCl
(3)写出过量的 F通入澄清石灰水的离子方程式CO2+OH-=HCO3-
(4)写出A 和B混合时的化学方程式Cl2+2HBr=2HCl+Br2.
分析 Cl2、O2、H2、CO2、HCl、HBr中A 和D 混合见光会发生爆炸,应为Cl2、H2的反应;C和D混合时,点燃也会发生爆炸,应为O2、H2的反应,则A为Cl2,C为O2,D为H2;若将F通入澄清石灰水,会产生浑浊,则F为CO2,再通入B或E,浑浊又变澄清,B或E为HCl、HBr的一种,将A和B混合时,有红棕色的液体在容器内壁生成,则B为HBr,E为HCl,结合对应物质的性质解答该题.
解答 解:Cl2、O2、H2、CO2、HCl、HBr中A 和D 混合见光会发生爆炸,应为Cl2、H2的反应;C和D混合时,点燃也会发生爆炸,应为O2、H2的反应,则A为Cl2,C为O2,D为H2;若将F通入澄清石灰水,会产生浑浊,则F为CO2,再通入B或E,浑浊又变澄清,B或E为HCl、HBr的一种,将A和B混合时,有红棕色的液体在容器内壁生成,则B为HBr,E为HCl,
(1)由以上分析可知A为Cl2,B为HBr,C为O2,D为H2,E为HCl,F为CO2,故答案为:Cl2; HBr;O2; H2; HCl; CO2;
(2)A 和D反应的化学方程式为H2+Cl2$\frac{\underline{\;光\;}}{\;}$2HCl,故答案为:H2+Cl2$\frac{\underline{\;光\;}}{\;}$2HCl;
(3)过量的二氧化碳通入澄清石灰水,生成碳酸氢钙,反应的离子方程式为CO2+OH-=HCO3-,
故答案为:CO2+OH-=HCO3-;
(4)A 和B混合时的化学方程式为Cl2+2HBr=2HCl+Br2,故答案为:Cl2+2HBr=2HCl+Br2.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质的性质以及反应类型的判断,题目有利于培养学生的综合分析问题的能力,注意相关基础知识的积累,难度不大.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | NaOH固体 | B. | NH4Cl固体 | C. | NaNO3固体 | D. | CH3COONa固体 |
| A. | 所有含氢元素的化合物中都存在氢键,氢键比范德华力强 | |
| B. | H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 | |
| C. | 氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 | |
| D. | 分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
| A. | 使用催化剂 | B. | 改变浓度 | C. | 升高温度 | D. | 降低温度 |
| A. | 玻璃、水泥、陶瓷属于传统的无机非金属材料 | |
| B. | 聚氯乙烯属于有机材料 | |
| C. | 光导纤维属于新型无机非金属材料 | |
| D. | 玻璃钢属于金属材料 |
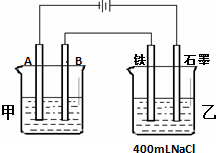 如图所示为相互串联的甲、乙两个电解池,试回答:
如图所示为相互串联的甲、乙两个电解池,试回答: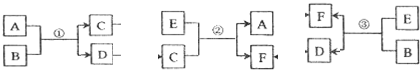
 ;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.