题目内容
19.恒温下,将Xmol N2和Ymol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)(1)若反应进行到t时刻,n(N2)=10mol,n (NH3)=4mol,计算X 的值.
(2)反应达到平衡时,混合气体的体积为672L(标准状况下),其中NH3的体积分数为20%,计算N2的转化率和Y的值.
分析 (1)根据生成氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量,t时刻时氮气的物质的量与参加反应的氮气的物质的量之和为X的值;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量.
解答 解:(1)反应进行到t时,测的N2为10mol,NH3为4mol,由方程式可知,参加反应的氮气的物质的量为4$\frac{1}{2}$mol=2mol,故氮气的起始物质的量为:10mol+2mol=12mol,即X=12.
故答案为:X的值为12;
(2)反应达平衡时,混合气体为$\frac{672L}{22.4mol/L}$=30mol,其中NH3的物质的量为30mol×20%=6mol.参加反应的氮气的物质的量为6mol×$\frac{1}{2}$=3mol,N2转化率=$\frac{3mol}{12mol}$×100%=25%;
根据三段式:N2(g)+3H2(g)?2NH3(g)
起始量:12 Y 0
转化量:3 9 6
平衡量:9 30-9-6=15 6
则Y=15+9=24mol.
故答案为:N2的转化率为25%,Y的值为24.
点评 考查化学平衡的有关计算,难度不大,注意基础知识的积累和化学平衡中三段式计算的掌握

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
9.现有下列三个图象:
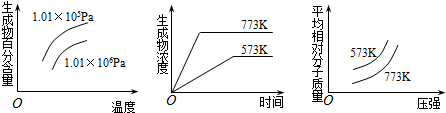
下列反应中全部符合上述图象的反应是( )

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |
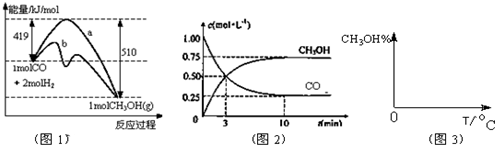
4.甲醇是重要的化工原料和清洁液体燃料.工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
(l)反应①是放热反应(选填“吸热”“放热”.
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
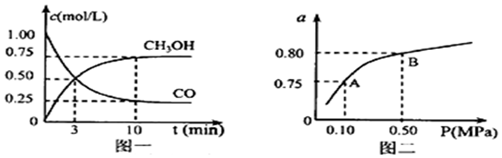
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
11.某实验室的尾气中含有较多的氯气,有毒,要吸收这些尾气,下列试剂最适合的是( )
| A. | Ca(OH)2 溶液 | B. | 饱和NaCl溶液 | C. | 自来水 | D. | NaOH溶液 |
8. 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( )
 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( )| A. | 该分子中有两个手性碳原子 | |
| B. | 两个苯环可以处于同一平面 | |
| C. | 能与NaHCO3和酸性KMnO4溶液反应 | |
| D. | 1mol该分子最多可与2molH2发生加成 |
9.下列关于钠及其化合物的说法中,不正确的是( )
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 少量的钠可以保存煤油中,如果露置在空气中会迅速和氧气反应生成过氧化钠 | |
| C. | 钠长期放罝在空气中,最终将变成碳酸钠 | |
| D. | 当钠与硫酸铜溶液反应时,有大量蓝色沉淀出现 |
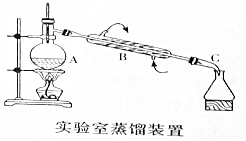 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.