题目内容
下列物质的电子式,正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:电子式
专题:化学用语专题
分析:A.氮气分子中除了有3对共用电子对外,每个氮原子各含有1对未成键电子对;
B.二氧化碳分子中碳原子与两个氧原子分别共用2对电子;
C.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子;
D.氧原子得到2个电子形成带2个单位负电的氧离子,氧离子与两个钾离子通过离子键结合成离子化合物.
B.二氧化碳分子中碳原子与两个氧原子分别共用2对电子;
C.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子;
D.氧原子得到2个电子形成带2个单位负电的氧离子,氧离子与两个钾离子通过离子键结合成离子化合物.
解答:
解:A.氮气中存在氮氮三键,氮气的电子式为 ,故A错误;
,故A错误;
B.二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故B错误;
,故B错误;
C.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为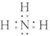 ,故C正确;
,故C正确;
D.氧化钾中,2个钾离子与1个氧离子通过离子键形成离子化合物,电子式为: ,故D错误;
,故D错误;
故选:C.
 ,故A错误;
,故A错误;B.二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
 ,故B错误;
,故B错误;C.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为
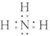 ,故C正确;
,故C正确;D.氧化钾中,2个钾离子与1个氧离子通过离子键形成离子化合物,电子式为:
 ,故D错误;
,故D错误;故选:C.
点评:本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则、明确离子化合物与共价化合物的电子式表示方法及区别是解题关键,题目难度不大.

练习册系列答案
相关题目
对室温下体积相同,浓度均为0.1mol?L-1的盐酸和醋酸两种溶液分别采取下列措施.有关叙述中一定正确的是( )
| A、加入稀释100倍后,两溶液的pH相同 |
| B、加入NaOH固体恰好中和后,两溶液的pH相同 |
| C、加入足量的小苏打固体充分反应后,两溶液中产生的CO2一样多 |
| D、分别加入足量的锌粉充分反应,反应开始时两酸产生H2的反应速率相等 |
不能用来说明金属X比金属Y还原性强的是( )
| A、把X和Y组成的合金放于潮湿的空气中,X先被腐蚀 |
| B、X原子最外层电子数比Y原子最外层电子数少 |
| C、X能从Y的盐溶液中把Y置换出来 |
| D、电解X和Y的盐混合液,阴极先析出Y |
下列叙述正确的是( )
| A、将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D、除去FeCl2中少量的FeBr2,加入适量氯水;再加四氯化碳萃取分液 |
下列各溶液中,pH最大的是( )
| A、pH=9的氨水溶液稀释1000倍 |
| B、pH=9的烧碱溶液稀释1000倍 |
| C、pH=5的盐酸溶液稀释1000倍 |
| D、pH=5的氯化铵溶液稀释1000倍 |
下列有关原电池和电解池的叙述正确的是( )
| A、纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 |
| B、甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-═CO2+5H2O |
| C、在铁上镀铜时,金属铜作阴极 |
| D、电解精炼铜时,电解质溶液中铜离子浓度不变 |
下列反应中,可用离子方程式H++OH-=H2O表示的是( )
| A、醋酸与氢氧化钾溶液 |
| B、稀硫酸与氢氧化钡溶液 |
| C、硫酸氢钠溶液与氢氧化钠溶液 |
| D、盐酸与氨水 |
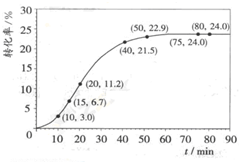 甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0