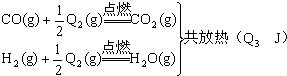题目内容
7.根据下列化学方程式:①2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O
②2Fe2++Cl2═2Fe3++2Cl-
③2Fe3++Cu═2Fe2++Cu2+
④Fe+Cu2+═Fe2++Cu
可判断MnO4-、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为( )
| A. | Fe3+>MnO4->Cl2>Cu2+ | B. | MnO4->Cl2>Fe3+>Cu2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+ | D. | Cu2+>Cl2>MnO4->Fe3+ |
分析 自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析解答.
解答 解:①2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,反应MnO4-中Mn元素化合价+7价变化为+2价,化合价降低做氧化剂,氯离子化合价-1价变化为0价,化合价升高失电子被氧化生成氯气,氧化性MnO4->Cl2,
②2Fe2++Cl2=2Fe3++2Cl-,Cl2中氯元素化合价0价变化为-1价,化合价降低做氧化剂,亚铁离子盐酸化合价+2价变化为+3价,元素化合价升高失电子被氧化得到氧化产物为Fe3+,氧化性Cl2>Fe3+,
③2Fe3++Cu=2Fe2++Cu2+,反应中Fe3+元素化合价+3价变化为+2价做氧化剂,Cu元素化合价0价变化为+2价元素化合价升高失电子被氧化得到氧化产物Cu2+,氧化性Fe3+>Cu2+,
④Fe+Cu2+=Fe2++Cu,反应中Cu2+元素化合价+2价变化为0价做氧化剂,Fe元素化合价0价变化为+2价元素化合价升高失电子被氧化得到氧化产物Fe2+,氧化性Cu2+>Fe2+,
可推断MnO4-、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为:MnO4->Cl2>Fe3+>Cu2+>Fe2+,
故选B.
点评 本题考查氧化性强弱判断方法,明确氧化性、还原性判断方法即可解答,会正确判断氧化剂、氧化产物是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列属于氧化还原反应的是( )
| A. | MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓ | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu |
12.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4 L氖气含有原子数为NA | |
| C. | 物质的量浓度为2 mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2 L H2O含有0.5NA分子 |
16.下列说法正确的是( )
| A. | 在常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA | |
| C. | 在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L | |
| D. | 标准状况下,1 mol CCl4的体积是22.4 L |
17.已知反应A(g)+3B(g)?2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2mol/(L•s),则以C的浓度变化表示的反应速率为( )
| A. | 1 mol/(L•s) | B. | 3 mol/(L•s) | C. | 4 mol/(L•s) | D. | 2 mol/(L•s) |
 3,3,4-三甲基己烷;
3,3,4-三甲基己烷; 2-乙基-1,3-丁二烯.
2-乙基-1,3-丁二烯.