题目内容
6.100克某种焊锡中含锡43.2%及含铅56.8%,试求:锡的物质的量0.363mol,铅的物质的量0.274mol.分析 先根据该焊锡中锡和铅的质量分数计算出二者质量,然后根据n=$\frac{m}{M}$分别计算出该焊锡中含有锡和铅的物质的量.
解答 解:铅的摩尔质量为207g/mol,锡的摩尔质量为119g/mol,
100克某种焊锡中含锡43.2%及含铅56.8%,则该焊锡中含有锡的物质的量为:$\frac{100g×43.2%}{119g/mol}$≈0.363mol,含有铅的物质的量为:$\frac{100g×56.8%}{207g/mol}$≈0.274mol,
故答案为:0.363mol;0.274mol.
点评 本题考查了物质的量的计算,题目难度不大,明确质量分数的含义为解答关键,注意掌握物质的量与摩尔质量之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
16.下列操作中,不正确的是( )
| A. | 金属Na着火,可立即用水扑灭 | |
| B. | 炒菜时油锅里着火了,可关掉火源并用锅盖盖灭 | |
| C. | 贮氯罐意外泄漏,应向贮氯罐周围空中喷洒稀NaOH溶液 | |
| D. | 闻氯气的气味时,应用手在瓶口轻轻煽动,使少量氯气进入鼻孔 |
14.将下列铁的化合物溶于盐酸,滴加KSCN溶液后颜色变化最不明显的是( )
| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | Fe(OH)3 |
1.某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度.
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
则V1=40mL,V2=10mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度.
实验步骤:
i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCI3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加试剂X.
①将KI和FeCl3反应的离子方程式补充完整.
2I-+2Fe3+?1I2+2Fe2+
②步骤iii中,试剂X是KSCN溶液.
③步骤ii和iii中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是ii中可观察到溶液分层,下层呈现紫红色,iii中可观察到溶液变红.
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度.
实验步骤:
i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCI3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加试剂X.
①将KI和FeCl3反应的离子方程式补充完整.
2I-+2Fe3+?1I2+2Fe2+
②步骤iii中,试剂X是KSCN溶液.
③步骤ii和iii中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是ii中可观察到溶液分层,下层呈现紫红色,iii中可观察到溶液变红.
6.下列关于钠元素的几种表达式错误的是( )
| A. | Na+的电子排布图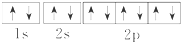 | |
| B. | Na+的结构示意图: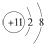 | |
| C. | 基态Na原子的电子排布式:1s22s22p53s2 | |
| D. | 基态Na原子的价电子排布式:3s1 |

