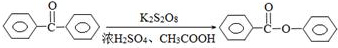题目内容
17.A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在C中充分燃烧能生成其最高价化合物BC2.D+与C2-具有相同的电子数.A在E中燃烧,产物溶于水得到一种强酸.回答下列问题:(1)B在元素周期表中的位置是第二周期IVA族,写出一种工业制备单质E方法的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑(或2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑).
(2)这五种元素两两之间能形成多种化合物,请写出A2C和DA相互反应的化学方程式NaH+H2O=NaOH+H2↑.
分析 A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;D+与C2-具有相同的电子数,则D处于IA族,C处于ⅥA族,则D为Na、C为O元素;B在C中充分燃烧生成其最高价化合物BC2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在E中燃烧,产物溶于水得到种强酸,则E为Cl,据此解答.
解答 解:A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;D+与C2-具有相同的电子数,则D处于IA族,C处于ⅥA族,则D为Na、C为O元素;B在C中充分燃烧生成其最高价化合物BC2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在E中燃烧,产物溶于水得到种强酸,则E为Cl.
(1)B为碳元素,在元素周期表中的位置是:第二周期IVA族,工业通常电解饱和食盐水或熔融氯化钠制备氯气,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑(或2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑),
故答案为:第二周期IVA族;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑(或2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑);
(2)H2O和NaH相互反应的化学方程式:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑.
点评 本题考查结构性质位置关系综合应用,关键是推断元素,注意掌握中学常见化学工业及金属氢化物,题目难度中等.

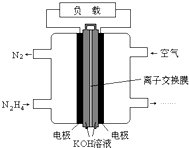 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A. | 电流从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O | |
| C. | 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
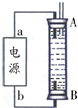
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
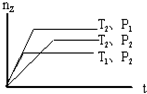 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,△H<0 | B. | T1<T2,P1>P2,△H>0 | ||
| C. | T1>T2,P1>P2,△H<0 | D. | T1>T2,P1<P2,△H>0 |
质除去,将对应的编号填入表中.
试剂:a水,b氢氧化钠溶液,c 溴水,d 酸性高
锰酸钾溶液,e生石灰.分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置.
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | c | D |
| 溴苯(液溴) | b | A |
| 苯(苯酚) | b | A |
| 乙醇(水) | e | C |
| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
| A. | CH4 | B. | C5H12 | C. | C8H18 | D. | C9H20 |
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.