题目内容
7.(1)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.①氮氧化物产生的环境问题是产生光化学烟雾或形成酸雨(写一种).
②氧化还原法消除氮氧化物的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
反应Ⅰ为:NO+O3═NO2+O2,生成11.2LO2(标准状况)时,转移电子的物质的量是1mol;反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(2)氨气在工农业生产中有重要应用.
①氮气用于工业合成氨,氮气的电子式为
 ;NH3的稳定性比PH3的强(填“强”或“弱”).
;NH3的稳定性比PH3的强(填“强”或“弱”).②空气吹脱法是目前消除NH3对水体污染的重要方法.在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因:氨在水中存在平衡为NH3+H2O?NH3•H2O?NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除.
分析 (1)①根据含氮化合物对环境的影响来回答,氮氧化物是污染性气体,容易形成光化学烟雾;
②化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;反应方程式中,系数之比等于物质的量之比;
(2)①氮气分子中存在氮氮三键,氮原子最外层为8电子;
②结合NH3+H2O?NH3•H2O?NH4++OH-及平衡移动分析.
解答 解:(1)①氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,
故答案为:产生光化学烟雾或形成酸雨;
②NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:1;6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)①氮气中N原子满足最外层8电子稳定结构,存在N≡N,则氮气的电子式为 ,非金属性N>P,则NH3的稳定性比PH3强,
,非金属性N>P,则NH3的稳定性比PH3强,
故答案为: ;强;
;强;
②在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,是因氨在水中存在平衡为NH3+H2O?NH3•H2O?NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除,
故答案为:氨在水中存在平衡为NH3+H2O?NH3•H2O?NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除.
点评 本题考查氮氧化物的有关知识,涉及氧化还原反应、平衡移动原理、非金属性比较等,综合性较强,侧重学生分析能力和计算能力的考查,注意知识的迁移应用,题目难度中等.

练习册系列答案
相关题目
17.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
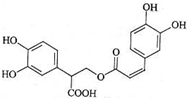

| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
18.南京大屠杀死难者国家公祭鼎用青铜铸造,关于铜的一种核素${\;}_{29}^{64}$Cu 下列说法正确的是( )
| A. | ${\;}_{29}^{64}$Cu 的核电荷数为 29 | B. | ${\;}_{29}^{64}$Cu 的质子数为 35 | ||
| C. | ${\;}_{29}^{64}$Cu 的中子数为 64 | D. | ${\;}_{29}^{64}$的核外电子数为 64 |
12.下列各组物质中,可用溴水溶液来鉴别的是( )
| A. | 乙烯与乙炔 | B. | 乙烯与甲烷 | C. | 苯与直馏汽油 | D. | 苯与CCl4 |
19.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素.X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍,下列叙述正确的是( )
| A. | 原子半径:W>R>Z | |
| B. | W的气态氢化物的热稳定性比Y的强 | |
| C. | Z与W形成的是离子化合物 | |
| D. | W的最高价氧化物对应水化物酸性比R的弱 |
16.两种气态烃组成的混合气体2.24L(标准状况),完全燃烧得0.16molCO2和3.6g水,下列说法正确的是( )
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
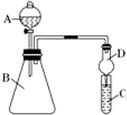 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.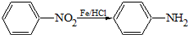 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.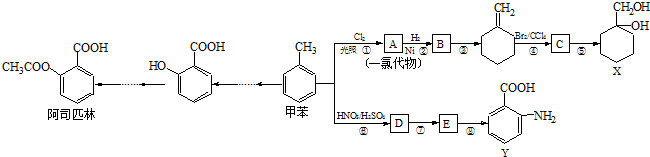
 ,C
,C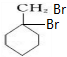 ,E
,E .
.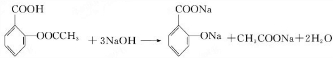 .
.