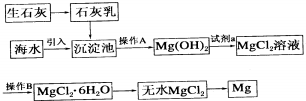
题目内容
19.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素.X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍,下列叙述正确的是( )| A. | 原子半径:W>R>Z | |
| B. | W的气态氢化物的热稳定性比Y的强 | |
| C. | Z与W形成的是离子化合物 | |
| D. | W的最高价氧化物对应水化物酸性比R的弱 |
分析 X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素,则X是H元素;X与Z同主族,则Z是Na元素;Y与W同主族,R最外层电子数是电子层数的2倍,则R是S元素,W是Cl元素,Y是F元素,然后结合元素周期律来解答.
解答 解:X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素,则X是H元素;X与Z同主族,则Z是Na元素;Y与W同主族,R最外层电子数是电子层数的2倍,则R是S元素,W是Cl元素,Y是F元素.
A.同一周期的元素,原子序数越大,原子半径越小,所以原子半径:W<R<Z,故A错误;
B.元素的非金属性Y>W,所以W的气态氢化物的热稳定性比Y的弱,故B错误;
C.Z与W形成的是NaCl,只含离子键,该物质是离子化合物,故C正确;
D.元素的非金属性Cl<S,所以W的最高价氧化物对应水化物HClO4酸性比R的强,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答本题的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
9.下列反应中,不属于氧化还原反应的是( )
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
10.现有 A、B、C、D 四种金属,进行如下实验:
①A、B 用导线相连后,同时插入稀硫酸中,A 极为负极;
②C、D 用导线相连后,同时浸入稀硫酸中,电子由 C→导线→D;
③A、C 相连后,同时浸入稀硫酸,C 极产生大量气泡;
④B、D 相连后,同时浸入稀硫酸中,D 极发生氧化反应.
则四种金属的活泼性顺序为( )
①A、B 用导线相连后,同时插入稀硫酸中,A 极为负极;
②C、D 用导线相连后,同时浸入稀硫酸中,电子由 C→导线→D;
③A、C 相连后,同时浸入稀硫酸,C 极产生大量气泡;
④B、D 相连后,同时浸入稀硫酸中,D 极发生氧化反应.
则四种金属的活泼性顺序为( )
| A. | A>B>C>D | B. | C>A>D>B | C. | A>C>D>B | D. | B>D>C>A |
14.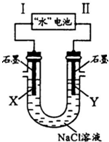 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl-+e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1 mol e-,U型管中消耗0.5 mol H2O | |
| D. | “水”电池内,每生成1 mol Na2Mn5O10,X电极上生成1 mol气体 |
11.下列物质中属于有机物的是( )
| A. | 甲烷 | B. | 二氧化碳 | C. | 煤 | D. | 碳酸 |
8.下列溶液中,氯离子浓度最大的是( )
| A. | 200mL 1mol/L的NaCl溶液 | B. | 150 mL 1mol/L的MgCl2溶液 | ||
| C. | 100mL 1mol/L的HCl溶液 | D. | 50mL 1mol/L的AlCl3溶液 |
13.下面四种变化中,有一种变化与其他三种变化类型不同的是( )
| A. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| C. | 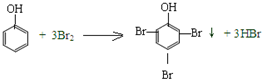 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
 ;NH3的稳定性比PH3的强(填“强”或“弱”).
;NH3的稳定性比PH3的强(填“强”或“弱”).