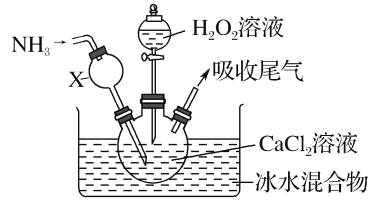
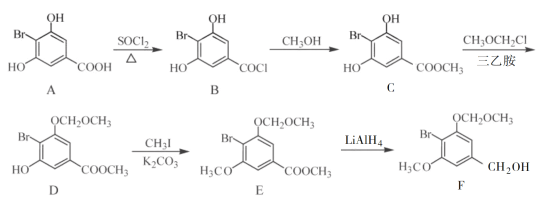
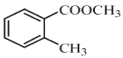
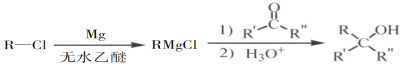题目内容
【题目】下列指定反应的离子方程式正确的是
A.向FeBr2溶液中通入少量Cl2:2Br-+ Cl2 = Br2+ 2Cl-
B.向NH4Al(SO4)2溶液中加入过量KOH溶液:Al3+ + 4OH- = AlO2- + 2H2O
C.用氢氧化钠溶液吸收工业废气中的NO2:2NO2 + 2OH- = NO3- + NO2- + H2O
D.用惰性电极电解AlCl3溶液:2Cl- + 2H2O ![]() Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
【答案】C
【解析】
A.还原性:Fe2+>Br-,所以向FeBr2溶液中通入少量Cl2,亚铁离子被氧化,离子方程式为: 2Fe2++ Cl2 =2Fe3++ 2Cl-,故A错误;
B.氢氧化铝溶于强碱溶液;向NH4Al(SO4)2溶液中加入过量NaOH溶液,反应的离子方程式为:Al3++ NH4++5OH-=AlO2-+2H2O+ NH3H2O,选项B错误;
C.用氢氧化钠溶液吸收工业废气中的NO2,反应的离子方程式为:2NO2+2OH-=NO3-+NO2-+H2O,选项C正确;
D.用惰性电极电解AlCl3溶液,反应的离子方程式为:2Al3++6Cl-+6H2O![]() 3Cl2↑+3H2↑+2Al(OH)3↓,选项D错误;
3Cl2↑+3H2↑+2Al(OH)3↓,选项D错误;
故答案选C。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目