题目内容
【题目】CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)设计简单实验证明CH3COOH为弱酸__。
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”):
n(H+)=___,![]() =___,
=___,![]() =__,c(OH-)=___。
=__,c(OH-)=___。
(3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是__(填写序号)
①反应需要的时间:CH3COOH>HCl
②开始反应的速率:HCl>CH3COOH
③参加反应的锌粉的物质的量:CH3COOH=HCl
④反应过程的平均速率:CH3COOH>HCl
⑤盐酸中有锌粉剩余
⑥CH3COOH溶液中有锌粉剩余
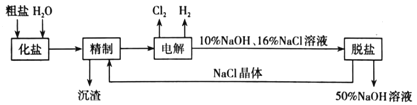
(4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是__。
A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体
(5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系__。
【答案】测定醋酸钠溶液的pH值,若pH大于7,则说明醋酸为弱酸 增大 不变 减小 增大 ③④⑤ A ④>①>②>③
【解析】
(1)若醋酸为弱酸,则醋酸钠水解;
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,CH3COOH、CH3COO-、H+的浓度均减小,CH3COOH![]() CH3COO-+H+正向移动;
CH3COO-+H+正向移动;
(3)OH-浓度相同的等体积的盐酸和CH3COOH,说明氢离子浓度相同,由于醋酸是弱酸,醋酸的浓度大于盐酸,盐酸的物质的量小于醋酸。
(4)饱和氯化钠溶液中存在溶解平衡NaCl(s)![]() Na+(aq)+Cl-(aq),加入浓盐酸后氯离子浓度增大,则溶解平衡向着逆向移动。
Na+(aq)+Cl-(aq),加入浓盐酸后氯离子浓度增大,则溶解平衡向着逆向移动。
(5)酸、碱抑制水电离,盐水解促进水电离。
(1)测定醋酸钠溶液的pH,若pH大于7,说明醋酸根离子水解,醋酸为弱酸;
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,CH3COOH![]() CH3COO-+H+正向移动,所以n(H+)增大;
CH3COO-+H+正向移动,所以n(H+)增大;![]() =
=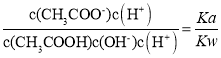 ,所以
,所以![]() 不变;
不变;![]() ,
,![]() 减小,所以
减小,所以 ![]() 减小;Kw不变,
减小;Kw不变,![]() 减小,所以c(OH-)增大。
减小,所以c(OH-)增大。
(3)①开始氢离子浓度相同,反应速率相同,开始后醋酸继续电离出氢离子,醋酸中氢离子浓度大于盐酸,醋酸反应速率快,所以反应需要的时间:CH3COOH<HCl,故①错误;②开始氢离子浓度相同,反应速率相同,故②错误;③放出氢气的质量相等,所以参加反应的锌粉的物质的量相等,故③正确;④放出氢气的质量相等,开始后醋酸反应速率大于盐酸,反应过程的平均速率:CH3COOH>HCl,故④正确;⑤醋酸的物质的量大于盐酸,放出氢气一样多,所以醋酸一定有剩余,则盐酸中有锌粉剩余,故⑤正确;⑥醋酸物质的量大于盐酸,若CH3COOH溶液中有锌粉剩余,说明醋酸完全反应,则醋酸放出的氢气大于盐酸,故⑥错误。答案选③④⑤;
(4)饱和氯化钠溶液中存在溶解平衡:NaCl(s)![]() Na+(aq)+Cl-(aq),由于加入浓盐酸,溶液中氯离子浓度增大,抑制了氯化钠的溶解,会析出白色的NaCl晶体,故选A。
Na+(aq)+Cl-(aq),由于加入浓盐酸,溶液中氯离子浓度增大,抑制了氯化钠的溶解,会析出白色的NaCl晶体,故选A。
(5)①纯水中水电离出的![]() =10-7;②氢氧化钠抑制水电离,pH=10的NaOH溶液,水电离出的
=10-7;②氢氧化钠抑制水电离,pH=10的NaOH溶液,水电离出的![]() =10-10;③醋酸抑制水电离,pH=3的醋酸溶液,水电离出的
=10-10;③醋酸抑制水电离,pH=3的醋酸溶液,水电离出的![]() =10-11;④醋酸钠水解,促进水电离,pH=10的CH3COONa溶液,水电离出的
=10-11;④醋酸钠水解,促进水电离,pH=10的CH3COONa溶液,水电离出的![]() =10-4。水的电离程度的大小关系是④>①>②>③。
=10-4。水的电离程度的大小关系是④>①>②>③。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案