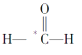题目内容
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
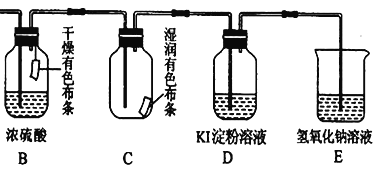
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
【答案】 2MnO4-+10Cl-+16H+=2Mn2+ +5Cl 2↑ +8H2O 1mol 11.2L Cl 2 +H2O = HClO + H++Cl- 可以 KMnO4>Cl2>I2
2MnO4-+10Cl-+16H+=2Mn2+ +5Cl 2↑ +8H2O 1mol 11.2L Cl 2 +H2O = HClO + H++Cl- 可以 KMnO4>Cl2>I2
【解析】
(1)根据单线桥的表示方法解答;
(2)根据书写离子方程式的步骤作答;
(3)根据电子守恒解答;
(4)干燥的Cl2没有漂白性,湿润的Cl2具有漂白性;同一氧化还原反应中,氧化性:氧化剂>氧化产物。
(1)在反应2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O中,Mn元素的化合价由KMnO4中的+7价降至MnCl2中的+2价,1molKMnO4得到5mol电子,Cl元素的化合价由HCl中的-1价升至Cl2中的0价,1molHCl失去1mol电子,反应中转移10e-,用单线桥标电子转移方向和数目为: ;故答案为:
;故答案为: ;
;
(2)KMnO4、HCl、KCl、MnCl2都改成离子形式,Cl2、H2O以化学式保留,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)根据电子守恒,反应中每消耗2molKMnO4,将有10molHCl被氧化成5molCl2,n(KMnO4)=![]() =0.2mol,则被氧化的HCl物质的量为1mol,生成0.5molCl2,在标准状况下Cl2的体积为0.5mol×22.4L/mol=11.2L;故答案为:1mol ; 11.2L;
=0.2mol,则被氧化的HCl物质的量为1mol,生成0.5molCl2,在标准状况下Cl2的体积为0.5mol×22.4L/mol=11.2L;故答案为:1mol ; 11.2L;
(4)干燥的Cl2没有漂白性,C中湿润的有色布条褪色的原因是氯气与水反应生成了具有漂白性的HClO,反应的离子方程式为Cl2+H2O=HClO+H++Cl-;若将B、C的顺序颠倒,Cl2能将湿润的有色布条褪色,用浓硫酸干燥后,Cl2不能使干燥的有色布条褪色,能达到实验目的;D中可观察到溶液由无色变为蓝色,说明D中发生反应:2KI+Cl2=2KCl+I2,在该反应中Cl2是氧化剂,I2是氧化产物,同一氧化还原反应中氧化性:氧化剂>氧化产物,则氧化性:Cl2>I2,在反应2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O中,KMnO4是氧化剂,Cl2是氧化产物,则氧化性:KMnO4>Cl2,Cl2、I2、KMnO4的氧化性由强到弱为KMnO4>Cl2>I2;故答案为:Cl2+H2O=HClO+H++Cl- ;可以KMnO4>Cl2>I2。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案